

 NaClO+H2↑.电解结束后一段时间,有同学发现铁电极表面变成红褐色,则反应方程式为3NaClO+2Fe+3H2O=2Fe(OH)3↓+3NaCl.
NaClO+H2↑.电解结束后一段时间,有同学发现铁电极表面变成红褐色,则反应方程式为3NaClO+2Fe+3H2O=2Fe(OH)3↓+3NaCl. 分析 (1)N、P元素的大量排放,会导致水体的富营养化;
(2)氧气的氧化性强于I2,故O2能将I-氧化为I2,氧气被还原为OH-;
(3)根据溶液一定要呈电中性来分析;
(4)除去海水中Ca2+、SO42-分别用过量的Na2CO3溶液和BaCl2溶液,试剂的加入顺序要满足:尽量不引入新的杂质离子,如果杂质离子引入了,则一定要容易除去;
(5)①溶液A所在的极上有H2生成,则为阴极,根据电极反应来分析;左侧电极为阳极,Cl-失电子发生氧化反应,据此分析;
②由图二可知,是用惰性电极来电解NaCl溶液来制备NaClO溶液,即Cl-在阳极放电,H+在阴极放电,据此写出电解方程式;铁电极表面变成红褐色,即有2Fe(OH)3沉淀生成,是铁与呈弱碱性的NaClO溶液发生了氧化还原反应导致.
解答 解:(1)含磷洗涤剂的大量使用,会导致N、P元素的大量排放,造成水体的富营养化,引起藻类的疯长,引发赤潮,故答案为:N,P;
(2)氧气的氧化性强于I2,故O2能将I-氧化为I2,氧气被还原为OH-,离子方程式为:4I-+O2+2H2O=2I2+4OH-,故答案为:4I-+O2+2H2O=2I2+4OH-;
(3)根据溶液一定要呈电中性,可知:c(Na+)+c(K+)+2c(Mg2+)=c(Cl-)+2c(SO42-),由于Na+、K+、Mg2+、Cl-均为0.02mol/L,故有:0.02mol/L+0.02mol/L+0.04mol/L=0.02mol/L+2c(SO42-),解得:c(SO42-)=0.03mol/L,故答案为:0.03;
(4)除去海水中Ca2+、SO42-分别用过量的Na2CO3溶液和BaCl2溶液(或Ba(OH)2),为了能除去过量的Ba2+,则Na2CO3溶液一定要在BaCl2或Ba(OH)2溶液之后加入;加入BaCl2或Ba(OH)2溶液后,会生成BaSO4沉淀,但此时不用先过滤,因为溶液中还有Ca2+和过量的Ba2+,加入Na2CO3溶液后,会又生成CaCO3和BaCO3沉淀,此时一并过滤除去即可,可节省实验用品和时间,
故答案为:BaCl2溶液(或Ba(OH)2),加入稍过量的Na2CO3溶液不会使生成的BaSO4沉淀溶解,且一次性过滤可节省实验用品和时间;
(5)①溶液A所在的极上有H2生成,则为阴极,电极上是来自于水的H+放电:2H2O+2e-=H2↑+2OH-,而中间为阳离子交换膜,Na+会从左侧移动到右侧,故溶液A为NaOH溶液;左侧电极为阳极,Cl-失电子发生氧化反应,根据电解质溶液为中性溶液,则电极反应为:3H2O+Cl--6e-=ClO3-+6H+;故答案为:NaOH溶液,3H2O+Cl--6e-=ClO3-+6H+;
②由图二可知,是用惰性电极来电解NaCl溶液来制备NaClO溶液,即Cl-在阳极放电:Cl--2e-+H2O=ClO-+2H+;H+在阴极放电:2H++2e-=H2↑,将阴阳极上放电的物质分别找到其来源后相加,即可得电解的化学方程式:NaCl+H2O NaClO+H2↑;铁电极表面变成红褐色,即有2Fe(OH)3沉淀生成,是铁与呈弱碱性的NaClO溶液发生了氧化还原反应,铁被氧化为氢氧化铁,NaClO被还原为NaCl,反应为:3NaClO+2Fe+3H2O=2Fe(OH)3↓+3NaCl.
NaClO+H2↑;铁电极表面变成红褐色,即有2Fe(OH)3沉淀生成,是铁与呈弱碱性的NaClO溶液发生了氧化还原反应,铁被氧化为氢氧化铁,NaClO被还原为NaCl,反应为:3NaClO+2Fe+3H2O=2Fe(OH)3↓+3NaCl.
故答案为:NaCl+H2O NaClO+H2↑;3NaClO+2Fe+3H2O=2Fe(OH)3↓+3NaCl.
NaClO+H2↑;3NaClO+2Fe+3H2O=2Fe(OH)3↓+3NaCl.
点评 本题考查了氧化还原反应的书写、海水的除杂以及除杂试剂的加入顺序和电极反应的书写,综合性较强,注意根据阴阳极反应来书写电解总反应的方法.


科目:高中化学 来源: 题型:解答题
 前四周期原子序数依次增大的六种元素A,B,D,X,Y,Z,基态时核外电子排布具有以下特征:A的电子层数和最外层电子数相等,非金属元素B的已成对电子数是未成对电子数的2倍,且A和B位于不同周期;D和X的价电子层中未成对电子均只有1个,并且D-和X+的电子相差为8;Y、Z与X位于同一周期,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2.回答下列问题:
前四周期原子序数依次增大的六种元素A,B,D,X,Y,Z,基态时核外电子排布具有以下特征:A的电子层数和最外层电子数相等,非金属元素B的已成对电子数是未成对电子数的2倍,且A和B位于不同周期;D和X的价电子层中未成对电子均只有1个,并且D-和X+的电子相差为8;Y、Z与X位于同一周期,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 阿司匹林的分子式是:C9H8O4 | |
| B. | 阿司匹林可以通过邻羟基苯甲酸与乙酸酯化反应制备,乙酸的用量应过量,可以提高邻羟基苯甲酸的转化率,同时也起到了溶剂的作用 | |
| C. | 原子经济性反应指原料分子中的原子全部转化成所需要的产物,不产生副产物,实现零排放,则阿司匹林制备符合原子经济性 | |
| D. | 阿司匹林分子中所有碳原子可以共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂和蛋白质都是天然高分子化合物,都能水解 | |
| B. | 天然气和液化石油气的主要成分都是烃,都能燃烧 | |
| C. | 苯和乙烯都含有碳碳双键,都能和H2发生加成反应 | |
| D. | 裂化汽油和四氯化碳都不溶于水,都可用于萃取溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
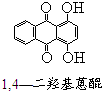 芳香族化合物A(C8H6O4)能与NaHCO3溶液反应生成CO2.由A与对二氯苯(
芳香族化合物A(C8H6O4)能与NaHCO3溶液反应生成CO2.由A与对二氯苯( )为原料经多步反应可合成1,4-二羟基蒽醌(结构如图所示).
)为原料经多步反应可合成1,4-二羟基蒽醌(结构如图所示). .
. $\stackrel{△}{→}$
$\stackrel{△}{→}$
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 灼热铜丝发生的现象变化为紫红色与黑色交替出现,甲醇发生还原反应 | |
| B. | C中有机产物易溶于水,与水分子间只形成1种氢键 | |
| C. | 检验C中产物的试剂可用1 mol•L-1的CuS04溶液2 mL和O.4 mol•L-1的NaOH溶液4 mL混合得到 | |
| D. | 可用酸性高锰酸钾溶液检验产物生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 甲 | 乙、丙、丁 |
| ① | 常见干燥剂 | 浓硫酸、石灰石、碱石灰 |
| ② | 常见合金 | 不锈钢、青铜、生铁 |
| ③ | 基本营养物质 | 蛋白质、维生素、糖类 |
| ④ | 腐蚀品 | 浓硫酸、烧碱、硝酸 |
| ⑤ | 碱性氧化物 | 过氧化钠、氧化镁、氧化铁 |
| ⑥ | 弱电解质 | 醋酸、一水合氨、水 |
| A. | ①②③ | B. | ④⑤⑥ | C. | ②④⑥ | D. | ①⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
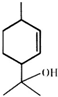
| A. | 松油醇的分子式为C10H16O | |
| B. | 1 mol松油醇与足量金属钠反应可生成标准状况下的H2 22.4L | |
| C. | 可以用酸性高锰酸钾溶液鉴别苯乙烯和松油醇 | |
| D. | 松油醇能发生加成反应、氧化反应、酯化等反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 防止“地沟油”重上餐桌的方法之一是将其制成生物柴油,在汽油中添加20%的生物柴油可减少50%的CO2、70%的SO2的排放,空气毒性可降低90% | |
| B. | 北京市600个居住小区率先进行垃圾分类试点,以促进垃圾的综合利用 | |
| C. | 减少CO2的方法有可将CO2制成干冰用于人工降雨、用石灰水吸收CO2、将CO2制成甲醇、种植树木吸收CO2等 | |
| D. | 限制化学发展,关停化工企业,消除污染源头 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com