
【题目】某可逆反应正向反应过程中能量变化如图,下列说法正确的是
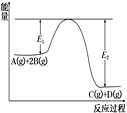
A. 该反应为吸热反应
B. 加入催化剂,反应速率增大,E1减小,E2减小,反应热不变
C. 增大压强,平衡正向移动,K增大
D. 当反应υ正(B)∶υ正(D)=2∶1时,到达平衡状态
 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g) ![]() 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间的变化如下图所示。下列说法中正确是
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间的变化如下图所示。下列说法中正确是
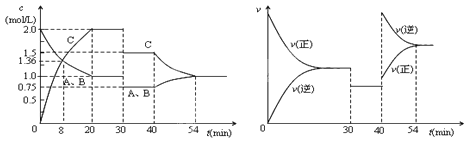
A.前8min A的平均反应速率为0.08mol/(L·s)
B.30min时扩大容器的体积,40min时升高温度
C.反应方程式中的x=1,正反应为吸热反应
D.30min和54min的反应的平衡常数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用14.2g无水硫酸钠配制成500mL溶液,其物质的量浓度为__________molL-1。若从中取出50 mL,其物质的量浓度为__________ molL-1。若将这50 mL溶液用水稀释到100 mL,所得溶液中![]() 的物质的量浓度为__________ molL-1,
的物质的量浓度为__________ molL-1,![]() 的物质的量浓度为__________ molL-1。
的物质的量浓度为__________ molL-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学探究Cu和H2O2的反应。
(猜想预测)
猜想1:Cu与H2O2不发生反应;
猜想2:Cu与H2O2可能发生氧化还原反应,H2O2作氧化剂。
(实验探究)
实验ⅰ:向装有0.5 g Cu的烧杯中加入20 mL 30% H2O2溶液,一段时间内无明显现象,10 小时后,溶液中有少量蓝色浑浊,Cu片表面附着少量蓝色固体。
(1)通过该实验证明了猜想2成立,写出该反应的化学方程式:________。
(继续探究)
针对该反应速率较慢,小组同学查阅资料,设计并完成了下列实验。
资料:Cu2+ + 4NH3 [ Cu(NH3)4] 2+ ,[ Cu(NH3)4] 2+为深蓝色;Cu(OH)2可溶于氨水形成深蓝色溶液。
装置 | 序号 | 试剂a | 现象 |
| ⅱ | 20 mL 30% H2O与4 mL 5 mol/L H2SO4 混合液 | Cu表面很快生产少量气泡,溶液逐渐变蓝,产生较多气泡 |
ⅲ | 20 mL 30% H2O2与4 mL5 mol/L氨水混合液 | 溶液立即变为深蓝色,产生大量气泡,Cu表面有少量蓝色不溶物 |
(2)实验ⅱ中:溶液变蓝的原因是________(用化学用语解释);经检验产生的气体为氧气,产生氧气的原因是________。
(3)对比实验ⅰ和ⅲ,为探究氨水对Cu的还原性或H2O2氧化性的影响,该同学利用如图装置继续实验。
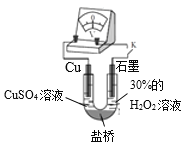
已知:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大。
a.K闭合时,电压为x。
b.向U型管右侧溶液中滴加氨水后,电压不变。
c.继续向U型管左侧溶液中滴加氨水后,电压增大了y。
该实验的结论:_________。利用该方法也可证明酸性增强可提高H2O2的氧化性,导致Cu溶解速率加快。
(4)对比实验ⅱ和ⅲ,实验ⅲ中产生氧气速率明显更快,可能的原因是_______。
(5)实验ⅲ有少量蓝色不溶物,小组同学加入少量NH4Cl可使其溶解,结合文字和化学用语解释不溶物溶解的原因:________。
(6)基于以上实验,影响Cu与H2O2反应速率的因素有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁“发蓝”是指在钢铁的表面形成一层四氧化三铁的技术过程。其中第一步反应为:3Fe+ NaNO2+ 5 NaOH= 3Na2FeO2+ H2O+ NH3↑。关于该反应说法正确的是![]()
A.反应中N元素被氧化
B.NaFeO2既是氧化产物也是还原产物
C.整个反应过程中每有![]() 参加反应就转移
参加反应就转移![]() 电子
电子
D.氧化剂与还原剂的物质的量之比为3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组做了如下关于钠的探究实验。
探究一:钠与水反应
![]() 该反应的离子方程式_______________________________。
该反应的离子方程式_______________________________。
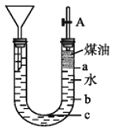
![]() 用如图所示的实验装置可以进行钠与水反应的实验,并可收集、检验生成的气体,煤油的密度为
用如图所示的实验装置可以进行钠与水反应的实验,并可收集、检验生成的气体,煤油的密度为![]() 液体物质添加完毕后,关闭活塞A,向煤油中加入一小块钠,立即塞好胶塞,反应开始前钠的位置在______处(填“a”、“b”或“c”)。
液体物质添加完毕后,关闭活塞A,向煤油中加入一小块钠,立即塞好胶塞,反应开始前钠的位置在______处(填“a”、“b”或“c”)。
![]() 若实验室要配制480mL0.
若实验室要配制480mL0.![]() NaOH溶液。
NaOH溶液。
①需______gNaOH。
②配制过程中,所用的玻璃仪器除玻璃棒、容量瓶、胶头滴管外,还有______。
③列操作会使所配NaOH溶液浓度偏小的是______(填序号)。
A.加水定容时俯视刻度线
B.容量瓶内壁附有水珠而未干燥处理
C.在溶解过程中有少量液体溅出烧杯外
D.颠倒摇匀后,发现凹液面低于刻度线又加水补上
探究二:钠与氯气反应
![]() 钠在氯气中燃烧的现象:剧烈燃烧, 火焰呈黄色且有______生成。
钠在氯气中燃烧的现象:剧烈燃烧, 火焰呈黄色且有______生成。
![]() 在实验室用浓盐酸与MnO2共热制取Cl2,并进行相关实验。利用上述方法制取标准状况下
在实验室用浓盐酸与MnO2共热制取Cl2,并进行相关实验。利用上述方法制取标准状况下![]() Cl2,则作还原剂的HCl的物质的量是______。
Cl2,则作还原剂的HCl的物质的量是______。
![]() 粗盐中含Ca2+、Mg2+、SO42-等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:
粗盐中含Ca2+、Mg2+、SO42-等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:
①加入过量的Na2CO3溶液 ②加入过量的BaCl2溶液 ③加入过量的NaOH溶液 ④用适量盐酸调节溶液的pH等于7 ⑤溶解 ⑥过滤 ⑦蒸发 正确的操作顺序是________(填选项字母)。
a.⑤②③①⑥④⑦ b.⑤①②③⑥④⑦ c.⑤②①③④⑥⑦ d.⑤③②①⑥④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将![]() 锌粒投入500mL 2mol/L的硫酸溶液中,试计算:
锌粒投入500mL 2mol/L的硫酸溶液中,试计算:
(1)产生的氢气在标准状况下的体积是__________;
(2)忽略溶液体积变化体积,反应后溶液中氢离子浓度是__________;
(3)要配制500mL 2mol/L的硫酸溶液,需用质量百分数为98%,密度为1.84g/cm3浓硫酸_______![]() 保留三位有效数字
保留三位有效数字![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,体积为10L的密闭容器中,2mol X和1mol Y进行反应:2X(g)+Y(g)![]() Z(g) ΔH<0,经20s达到平衡,生成0.5mol Z。下列说法正确的是
Z(g) ΔH<0,经20s达到平衡,生成0.5mol Z。下列说法正确的是
A.该反应平衡常数的值为1
B.将容器体积变为20L,Z的平衡浓度减小为0.025mol/L
C.以X浓度变化表示的反应速率为0.005mol/(L·s)
D.当X、Y、Z的浓度相等时,证明反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为石墨电极,E、F分别为短周期相邻的两种活泼金属中的一种,且E能与NaOH溶液反应。按图接通线路,反应一段时间,当电路中通过1.0×10-3mol电子时,下列叙述正确的是( )
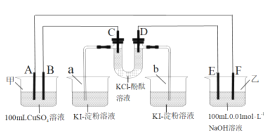
A.U型管中的D端先变红,b烧杯中的溶液会变蓝
B.a烧杯中最多有0.127gI2(KI足量)生成,甲池中的质量会减少0.04g(CuSO4溶液足量)
C.A极产生气体的体积为5.6mL,甲池溶液的pH值为2
D.E电极附近的溶液无明显现象产生
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com