
| A. | H2(HCl):通过水洗涤 | B. | NO(NH3):通过水洗涤 | ||
| C. | NH4Cl(NaCl):加热混合物 | D. | NH4Cl溶液(I2):用CCl4萃取 |
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案科目:高中化学 来源: 题型:解答题
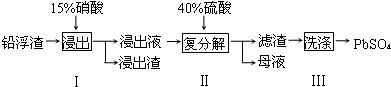
| 化学式 | CaSO4 | Ag2SO4 | PbSO4 |
| Ksp | 4.9×10-5 | 1.2×10-5 | 1.6×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其分子结构呈三角形 | B. | 分子中不存在孤对电子 | ||
| C. | 它的沸点比三氯化磷沸点低 | D. | 三氯化氮水解有硝酸生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
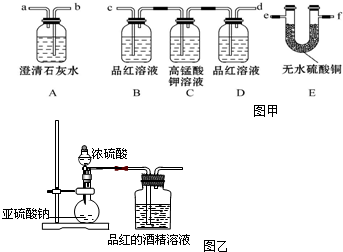
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | I-是该反应的催化剂 | |
| B. | H2O2分解的速率取决于第二步反应的快慢 | |
| C. | 反应物的总能量比生成物总能量低98kJ | |
| D. | 第一步H2O2被还原,第二步H2O2既被氧化又被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
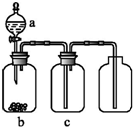 用如图装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),可行的是( )
用如图装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),可行的是( )| 气体 | a | b | c | |
| A | CO2 | 稀盐酸 | CaCO3固体 | 浓硫酸 |
| B | NO2 | 浓硝酸 | 铜片 | NaOH溶液 |
| C | SO2 | 浓硫酸 | 铜片 | 酸性KMnO4溶液 |
| D | NH3 | 浓氨水 | 生石灰 | 浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液、稀盐酸 | B. | NaCl溶液、KNO3溶液 | ||
| C. | Na2CO3溶液、澄清石灰水 | D. | Na2CO3溶液、稀硝酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com