
【题目】物质A~G有如图所示转化关系(部分生成物没有列出).其中A是常见的金属单质,E、F是气体.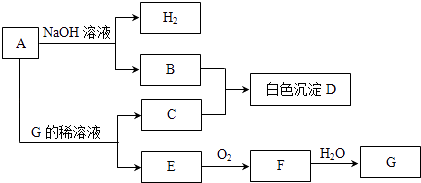
请回答下列问题:
(1)写出下列物质的化学式:A、D、G;
(2)B和C反应生成D的离子方程式为;
(3)A在碱性溶液中和NO3﹣反应时生成B和NH3 , 总反应的离子方程式为;
(4)相同条件下,向500mLE、F的混合气体中通入187.5mLO2 , 所有气体可恰好完全被水吸收生成G,则E和F的体积比为 .
(5)等体积的E、F通入NaOH溶液中可生成盐和水,反应的化学方程式为 . 室温下,0.1mol/L的上述盐溶液pH=8.3,原因是(用离子方程式表示)该溶液中所有离子按浓度由大到小排列的顺序为 .
【答案】
(1)A;Al(OH)3;HNO3
(2)Al3++3AlO2﹣+6H2O=4Al (OH)3↓
(3)4H2O+8Al+5OH﹣+3NO3﹣=3AlO2﹣+NH3↑
(4)1:3
(5)NO+NO2+2NaOH=2NaNO2+H2O;NO2﹣+H2O?HNO2+OH﹣;c(Na+)>c(NO2﹣)>c(OH﹣)>c(H+)
【解析】解:(1)依据推断可知ADG分别为:Al,Al(OH)3 , HNO3;所以答案是:Al,Al(OH)3 , HNO3;(2)B和C反应生成D的反应是偏铝酸钠和硝酸铝在水溶液中发生的双水解反应生成氢氧化铝沉淀,反应的离子方程式为:Al3++3AlO2﹣+6H2O=4Al (OH)3↓;所以答案是:Al3++3AlO2﹣+6H2O=4Al (OH)3↓;(3)A在碱性溶液中和NO3﹣反应时生成B和NH3 , 总反应的离子方程式为4H2O+8Al+5OH﹣+3NO3﹣=3AlO2﹣+NH3↑;所以答案是:4H2O+8Al+5OH﹣+3NO3﹣=3AlO2﹣+NH3↑;(4)相同条件下,向500mLE、F的混合气体中通入187.5mLO2 , 所有气体可恰好完全被水吸收生成G,E为NO,F为NO2 , G为HNO3 , 气体在相同条件下,条件比等于物质的量之比,设NO为x,NO2为y,4NO+3O2+2H2O=4HNO3 , 4NO2+O2+2H2O=4HNO3 ,
x+y=500![]() +
+ ![]() =187.5
=187.5
x=125
y=375
则E和F的体积比为1:3,
所以答案是:1:3;(5)等体积的E、F通入NaOH溶液中可生成亚硝酸盐和水,反应的化学方程式为:NO+NO2+2NaOH=2NaNO2+H2O;室温下,0.1mol/L的上述盐溶液pH=8.3,说明亚硝酸钠水解显碱性,NO2﹣+H2OHNO2+OH﹣;溶液中所有离子按浓度由大到小排列的顺序为c(Na+)>c(NO2﹣)>c(OH﹣)>c(H+);所以答案是:NO+NO2+2NaOH=2NaNO2+H2O;NO2﹣+H2OHNO2+OH﹣;c(Na+)>c(NO2﹣)>c(OH﹣)>c(H+);


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)下图为四种粒子的结构示意图,完成以下填空: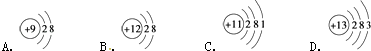
属于阳离子结构的粒子是(填字母序号,下同);A粒子的半径B粒子的半径(填“>”、“<”或“=”).
(2)有机物M经过太阳光光照可转化成N,转化过程如下: 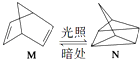 △H=+88.6kJmol﹣1则M、N相比,较稳定的是 .
△H=+88.6kJmol﹣1则M、N相比,较稳定的是 .
(3)由氢气和氧气反应生成1mol水蒸气放出热量241.8kJ,写出该反应的热化学方程式为: .
(4)一定温度下在某定容容器中发生反应:2A(g)+3B(g)2C(g),开始时,A的浓度为2molL﹣1 , B的浓度为4molL﹣1 , 2min后,A的浓度减少0.8molL﹣1 , 则①v(B)= , v(C)= .
②在2min末,C的浓度是 , B的浓度是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用硫酸分解磷尾矿[主要成份为Ca5(PO4)3F]可制得中强酸磷酸H3PO4。请回答:
(1)Na2HPO4溶液呈碱性,则在该溶液中c(H2PO4-)_____c(PO43-)(填“>”、“<”、“=”),向Na2HPO4溶液中加入足量的CaCl2溶液,溶液显酸性,溶液显酸性的原因是(从电离平衡移动角度分析):________________________。
(2)Ca5(PO4)3F(s) +OH-(aq)![]() Ca5(PO4)3(OH) (s)+F-,该温度下,溶液中c(F-)随溶液的pH和温度(T)的变化曲线如图所示。
Ca5(PO4)3(OH) (s)+F-,该温度下,溶液中c(F-)随溶液的pH和温度(T)的变化曲线如图所示。
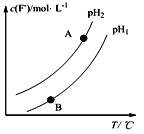
则:适当______温度有利于磷尾矿转化为羟基磷灰石(填“升高”、“降低”);pH1___pH2(填“>”、“<”、“=”);A、B两点的溶液中F—的速率v(A)____v(B)(填“>”、 “<”、“=”);
(3)已知:25℃时,H3PO4的电离平衡常数:K1=7.52×10-3;K2=6.23×10-8;K3=6.23×10-13,则:H3PO4(aq)+OH-(aq)![]() H2PO4-(aq)+H2O (l)的平衡常数K=____________。
H2PO4-(aq)+H2O (l)的平衡常数K=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生产、生活密切相关,下列叙述中正确的是( )
A.泰国银饰和土耳其彩瓷是“一带一路”沿线国家的特色产品,其主要成分均为金属材料
B.从石墨中剥离出的石墨烯薄片能导电,因此是电解质
C.二氧化硫和氨气都易液化,液氨常用作制冷剂
D.生理盐水可用于养殖场消毒,以杀死H7N9等病毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于油脂的叙述中,错误的是( )
A.从溴水中提取溴可用植物油作萃取剂
B.用热的烧碱溶液可以区别植物油和矿物油
C.生产盐酸和人造脂肪都必须用氢气做原料
D.硬水使肥皂的去污能力减弱,是因为发生了沉淀反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)中一种重要的掺杂剂.实验室要用黄磷(白磷)与干燥的Cl2模拟工业生产制取PCl3 , 装置如下图所示:(部分夹持装置略去)
已知黄磷与少量Cl2反应生成PCl3 , 与过量Cl2反应生成PCl5和HCl,遇O2会生成POCl3 , POCl3溶于PCl3 , PCl3、POCl3的熔沸点见下表:
物质 | 熔点/℃ | 沸点/℃ |
PCl3 | ﹣112 | 75.5 |
PCl5 | 2 | 105.3 |
请回答下列问题
(1)装置中制氯气的离子方程式为
(2)B中的试剂是 , E中次冷水的作用是 , F中碱石灰的作用是
(3)实验时,检查装置气密性后,先打开K3通入干燥的CO2 , 再迅速加入黄磷.通干燥CO2的作用是通过控制K1、K2能除去A、B装置中的空气,具体的方法是
(4)粗产品含有POCl3、PCl3等,加入黄磷加热除去PCl5 , 通过(填实验操作的名称),即可得到纯净的PCl3
(5)通过下面方法可测定产品中PCl3的质量分数.①迅速称取100g产品,加水反应后配成250mL溶液;
②取以上溶液25.0mL,向其中加入0.1mol 10mL碘水,充分反应;③向②所得溶液中加入几滴淀粉溶液,用0.1mol/L的Na2S2O3溶液滴定,滴定终点现象是
④重复②、③操作,平均消耗Na2S2O3溶液8.40mL.已知H3PO3+H2O+I2=H3PO4+2HI,I2+2Na2S2O3=2NaI+Na2SO4根据以上数据,该产品中PC3的质量分数是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别向下列溶液中加入少量的过氧化钠固体,不会出现浑浊的是 ( )
A.Na2CO3溶液
B.FeCl3溶液
C.饱和Ca(OH)2溶液
D.CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在101kPa 25℃时,1.0g乙烷气体完全燃烧生成液态水时放出热量52.0kJ,则乙烷燃烧的热化学方程式为( )
A. C2H6(g)+![]() O2(g)═2CO2(g)+3H2O(l)△H=﹣1560kJmol﹣1
O2(g)═2CO2(g)+3H2O(l)△H=﹣1560kJmol﹣1
B. 2C2H6(g)+7O2(g)═4CO2(g)+6H2O(g)△H=﹣1560kJmol﹣1
C. 2C2H6(g)+7O2(g)═4CO2(g)+6H2O(l)△H=+3120 kJmol﹣1
D. C2H6(g)+![]() O2(g)═2CO2(g)+3H2O(l)△H=﹣52.0kJmol﹣1
O2(g)═2CO2(g)+3H2O(l)△H=﹣52.0kJmol﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com