
分析 加入足量盐酸,与氢氧化钡和碳酸钡反应,其中碳酸钡生成二氧化碳气体,放出224毫升气体(标况)物质的量为$\frac{224×1{0}^{-3}}{22.4}$=10-2mol,所以碳酸钡的物质的量为0.01mol,然后加入硫酸,生成硫酸钡,溶液中钡离子的物质的量为0.1×10=1mol,所以氢氧化钡的物质的量为1-0.01=0.09mol,然后根据质量为100g,求出氢氧化钠的质量,再根据氢氧化钠的纯度=$\frac{氢氧化钠的质量}{100g}×100%$,计算求解.
解答 解:加入足量盐酸,与氢氧化钡和碳酸钡反应,其中碳酸钡生成二氧化碳气体,放出224毫升气体(标况)物质的量为$\frac{224×1{0}^{-3}}{22.4}$=10-2mol,所以碳酸钡的物质的量为0.01mol,然后加入硫酸,生成硫酸钡,所以溶液中钡离子的物质的量等于硫酸的物质的量,则溶液中钡离子的物质的量为0.1×10=1mol,所以氢氧化钡的物质的量为1-0.01=0.09mol,所以氢氧化钠的质量为:100g-0.01×197g-0.09×171g=82.64g,所以样品含氢氧化钠的纯度为:$\frac{82.64g}{100g}×100%$=82.64%,答:样品含氢氧化钠的纯度为82.64%.
点评 根据质量守恒定律,氢氧化钠固体质量等于100g-碳酸钡的质量-氢氧化钡的质量,然后根据氢氧化钠的质量与总质量之比较简便.


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:选择题
| A. | 锌粒与稀硫酸的反应 | B. | 灼热的木炭与CO2反应 | ||
| C. | 镁条的燃烧 | D. | NaOH溶液与NH4Cl溶液的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,正极的反应式是:PbO2+SO42-+4H++2e-═PbSO4+2H2O | |
| B. | 放电时,电解质溶液中的H+向负极移动 | |
| C. | 充电时,阳极的电极反应为:PbSO4+2e-═Pb(s)+SO42- | |
| D. | 充电时,当有20.7gPb生成时,转移的电子为0.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 结晶 | B. | 萃取 | C. | 过滤 | D. | 蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用溴水能区分乙酸、乙烯、苯、四氯化碳 | |
| B. | 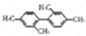 分子中至少有11个碳原子处于同一平面上 分子中至少有11个碳原子处于同一平面上 | |
| C. | 甘氨酸(H3N-CH2COOH)、丙氨酸[CH3CH(NH2)COOH]、谷氨酸[HOOC-CH2CH2CH(NH2)COOH]一定条件下形成链状三肽的结构最多有3种 | |
| D. | 1mol有机物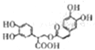 一定条件下能和6molNaOH反应 一定条件下能和6molNaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 短周期元素形成离子后,最外层电子达到8电子稳定结构 | |
| B. | 同一主族元素的原子,最外层电子数相同,化学性质完全相同 | |
| C. | 不同的核素,有不同的化学性质 | |
| D. | 第三周期主族元素的最高正化合价在数值上等于它所处的主族序数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
| 含氧酸 | Cl-OH |  |  |  |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
 .亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH=Na2HPO3+2H2O.
.亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH=Na2HPO3+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{b(1-a)}{7}$ | B. | $\frac{1-a}{7}$ | C. | $\frac{a}{8}$ | D. | 无法确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com