
【题目】煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
I.将水蒸气通过红热的炭即可产生水煤气。反应为:C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
能使化学反应速率加快的措施有________(填序号)。
①升高反应温度 ②增加C的物质的量
③密闭定容容器中充入CO(g) ④随时吸收CO、H2转化为CH3OH
II.工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。

(1)图1是表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化情况。从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=__________________________;
(2)图2表示该反应进行过程中能量的变化。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。请结合图像解释催化剂加快化学反应速率的原因_____________________,写出该反应的热化学方程式_________________________________,催化剂____________(填“改变”或“不改变”)反应的焓变。
(3)该反应平衡常数K为__________________________。
(4)恒容条件下,下列措施中能使![]() 增大的有_________________。
增大的有_________________。
a.升高温度 b.再充入2molH2 c.充入He气 d.使用催化剂.
III.下图是表示在一容积为2 L的密闭容器内加入2 mol的CO和6 mol的H2,在一定条件下发生如下反应:CO(g)+2H2(g) ![]() CH3OH(g) ΔH<0,该反应的逆反应速率与时间的关系曲线:
CH3OH(g) ΔH<0,该反应的逆反应速率与时间的关系曲线:

①由图可知反应在t1、t3、t7时都达到了平衡,而在t2、t8时都改变了条件,试判断t8时改变的条件可能是_______________。
②若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系曲线______________。
【答案】①③0.15molL﹣1min﹣1催化剂与反应物分子形成中间态,极大降低了反应活化能CO(g)+2H2(g)=CH3OH(g)△H=﹣91kJmol﹣1不改变12 L 2/ mol 2b使用了催化剂
【解析】
I.从影响反应速率的因素分析;
II.(1)根据v=△c/△t进行计算;
(2)催化剂加快化学反应速率的原因催化剂与反应物分子形成中间态,极大降低了反应活化能;利用反应前后的总能量来分析反应的能量变化,写出热化学方程式;催化剂不能改变反应的终始态;
(3)利用各物质平衡的浓度来计算化学平衡常数;
(4)使n(CH3OH)/n(CO)应采取措施,使平衡向正反应移动,注意不能增大一氧化碳或降低甲醇的量。
III.该反应是气体的体积减小的反应,增大压强,平衡向正反应方向移动,正反应为放热反应,升高温度平衡向逆反应方向移动,结合逆反应速率的变化解答;
I.C(s)+H2O(g)![]() CO(g)+H2(g) ①升高反应温度加快反应速率,故正确;
CO(g)+H2(g) ①升高反应温度加快反应速率,故正确;
②增加C的物质的量,因为C为固体,所以增加C的物质的量,反应物的浓度没变,则反应速率不变,故错误;
③密闭定容容器中充入CO(g),增大生成物浓度,则正逆反应速率均增大,故正确;
④随时吸收CO、H2转化为CH3OH,则减小生成物的浓度,逆反应速率减小,正反应速率随之也减小,故错误;
故选①③。
II.(1)v(CO)=(1-0.25)mol·L-1/10min=0.075 mol·L-1·min-1
根据CO(g)+2H2(g)![]() CH3OH(g),v(H2)=2v(CO)=2×0.075 mol·L-1·min-1=0.15 mol·L-1·min-1;
CH3OH(g),v(H2)=2v(CO)=2×0.075 mol·L-1·min-1=0.15 mol·L-1·min-1;
(2)催化剂加快化学反应速率的原因催化剂与反应物分子形成中间态,极大降低了反应活化能;
由图可知,该反应中反应物的总能量大于生成物的总能量,故该反应为放热反应;由图可知,反应物为1molCO(g)和2molH2(g),生成物为1molCH3OH(g),△H=419-510=-91 kJ·mol-1,故反应的热化学方程式为:CO(g)+2H2(g)=CH3OH(g)△H=-91 kJ·mol-1;
催化剂不能改变反应的终始态,催化剂不改变反应的焓变。
(3) CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
开始(mol·L-1) 1 2 0
转化(mol·L-1) 0.75 1.5 0.75
平衡(mol·L-1) 0.25 0.5 0.75
则化学平衡常数K=![]() ==12;
==12;
(4)a.该反应正反应是放热反应,升高温度平衡向逆反应移动,n(CH3OH)/n(CO)减小,故a错误;
b.再通入2molH2,平衡向正反应移动,n(CH3OH)/n(CO)增大,故b正确;
c.充入He(g),使体系压强增大,容器的容积不变,反应混合物的浓度不变,平衡不移动,n(CH3OH)/n(CO)不变,故b错误;
d.使用催化剂,平衡不移动,n(CH3OH)/n(CO)不变,故d错误;
故选b。
III.①t8时正逆反应速率都增大且相等,平衡不移动,应是加入催化剂;
②若t4时降压,正逆反应速率都减小,并且平衡向逆反应进行,t5时达到平衡,t6时增大反应物的浓度,瞬间正反应速率增大,逆反应不变,则t4~t6时逆反应速率与时间的关系曲线为 。
。


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:
【题目】银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下:
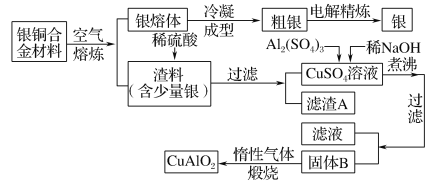
[注:Al(OH)3和Cu(OH)2开始分解的温度分别为450 ℃和80 ℃]
(1)电解精炼银时,阴极反应式为___________________________。
滤渣A与稀硝酸反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学反应方程式为________________________。
(2)固体混合物B的组成为________;
(3)完成煅烧过程中一个反应的化学方程式:__
________CuO+________Al2O3![]() ________CuAlO2+________。
________CuAlO2+________。
(4)CuSO4溶液也可用于制备胆矾,其基本操作是____________、过滤、洗涤和干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把3mol P和2.5mol Q置于2L密闭容器中,发生如下反应:3P(g)+Q(g)![]() xM(g)+2N(g),5min后达到平衡生成1mol N,经测定这5min内 M的平均速率是0.1mol/(L·min),下列叙述错误的是
xM(g)+2N(g),5min后达到平衡生成1mol N,经测定这5min内 M的平均速率是0.1mol/(L·min),下列叙述错误的是
A. 5min内P的平均反应速率为0.15mol/(L·min)
B. Q的平衡浓度为1mol/L
C. Q的转化率为25%
D. x是2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.手机、电脑中使用的锂电池属于一次电池
B.铅蓄电池放电时,正极与负极质量均增加
C.二次电池充电时,正极与外接电源的负极相连
D.燃料电池工作时,燃料在电池中燃烧,热能转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的N2、H2气体充入某密闭容器中,在一定条件下发生反应并达到平衡:N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0。当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是( )
2NH3(g) ΔH<0。当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是( )
选项 | 改变条件 | 新平衡与原平衡比较 |
A | 增大压强 | N2的浓度一定变小 |
B | 升高温度 | N2的转化率变小 |
C | 充入一定量H2 | H2的转化率不变,N2的转化率变大 |
D | 使用适当催化剂 | NH3的体积分数增大 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图实验装置进行实验不能达到目的的是

选项 | 反应及实验目的 | 试剂X | 试剂Y |
A | 电石与饱和食盐水混合,检验乙炔气体 | CuSO4溶液 | 酸性KMnO4溶液 |
B | 二氧化锰与浓盐酸混合加热,验证氯、溴、碘单质氧化性依次减弱 | NaBr溶液 | KI溶液 |
C | 乙醇与浓硫酸加热至170℃,证明发生了消去反应 | NaOH溶液 | Br2的CC14溶液 |
D | 乙酸溶液与碳酸钠固体混合,探究乙酸、碳酸和苯酚的酸性强弱 | 饱和NaHCO3溶液 | 苯酚钠溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果汁是人们喜欢的饮料。由于此饮料中含有Fe2+,现榨的苹果汁在空气中会由淡绿色变为棕黄色。若榨汁时加入维生素C,可有效防止这种现象发生,说明维生素C具有
A.氧化性B.酸性C.碱性D.还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理(平衡移动原理)解释的是
①溴水中存在化学平衡:Br2+H2O ![]() HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
②铁在潮湿的空气中易生锈
③二氧化氮与四氧化二氮的平衡体系,增大压强后颜色加深
④合成氨反应,为提高氨的产率,理论上应采取降低温度的措施
⑤钠与氯化钾共融制备钾:Na(l)+KCl(l) ![]() K(g)+NaCl(l)
K(g)+NaCl(l)
⑥反应CO(g)+NO2(g) ![]() CO2(g)+NO(g)(正反应为放热反应),达到化学平衡后,升高温度体系的颜色加深
CO2(g)+NO(g)(正反应为放热反应),达到化学平衡后,升高温度体系的颜色加深
A. ①④ B. ②③ C. ②⑥ D. ②③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷。
(1)工业上可用煤制天然气,生产过程中有多种途径生成CH4。
写出CO与H2反应生成CH4和H2O的热化学方程式____________
已知: CO(g)+H2O(g)![]() H2(g)+CO2(g) ΔH=-41kJ·mol-1
H2(g)+CO2(g) ΔH=-41kJ·mol-1
C(s)+2H2(g)![]() CH4(g) ΔH=-73kJ·mol-1
CH4(g) ΔH=-73kJ·mol-1
2CO(g)![]() C(s)+CO2(g) ΔH=-171kJ·mol-1
C(s)+CO2(g) ΔH=-171kJ·mol-1
(2)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式________________________ 。
(3)天然气的一个重要用途是制取H2,其原理为:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)。在密闭容器中通入物质的量浓度均为0.1mol·L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图1所示,则压强P1_________P2(填“大于”或“小于”);压强为P2时,在Y点:v(正)___________v(逆)(填“大于”、“小于”或“等于”)。
2CO(g)+2H2(g)。在密闭容器中通入物质的量浓度均为0.1mol·L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图1所示,则压强P1_________P2(填“大于”或“小于”);压强为P2时,在Y点:v(正)___________v(逆)(填“大于”、“小于”或“等于”)。

(4)以二氧化钛表面覆盖CuAl2O4为催化剂,可以将CH4和CO2直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如图2所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是________________。
②为了提高该反应中CH4的转化率,可以采取的措施是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com