
【题目】A—J是中学化学常见的物质,它们之间的转化关系如下图所示(部分产物已略去)。已知A是一种高熔点物质,常用作耐火材料D是一种红棕色固体,可用作涂料。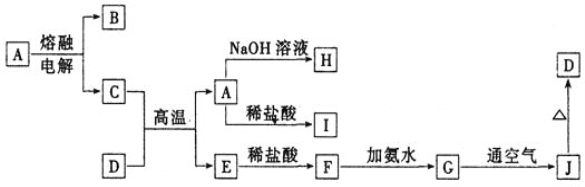
回答下列问题:
(1)A物质的名称为___________,D的化学式为_________。
(2)G→J的反应现象为______________其化学方程式为:_______________
(3)写出下列离子方程式:A→H_______________________
F→G _____________________
(4)写出C+D→A+E的化学方程式为________________________
【答案】氧化铝Fe2O3白色沉淀迅速变成灰绿色,最终变成红褐色4Fe(OH)2+O2 + 2H2O=4Fe(OH)3Al2O3 + 2OH-=2 AlO2—+ H2OFe2++2NH3·H2O=Fe(OH)2 +2NH![]() 2 Al+ Fe2O3=2 Fe+ Al2O3
2 Al+ Fe2O3=2 Fe+ Al2O3
【解析】A是高熔点物质,常用作耐火材料,根据转化图,条件是电解熔融,因此推出A为Al2O3,D是一种红棕色固体,常用作涂料,即D为Fe2O3,C和Fe2O3在高温下发生反应,属于铝热反应,即C为Al,B为O2,氧化铝和NaOH反应,则H为NaAlO2,氧化铝和稀盐酸反应,则I为AlCl3,E为Fe,F为FeCl2,G为Fe(OH)2,J为Fe(OH)3,(1)A的名称为氧化铝,D的化学式为Fe2O3;(2)4Fe(OH)2+O2+2H2O=4Fe(OH)3,现象是白色沉淀迅速转变成灰绿色,最终变成红褐色;(3)氧化铝表现两性,和NaOH的反应是Al2O3+2OH-=2AlO2-+H2O,Fe2++2NH3·H2O=Fe(OH)2↓+2NH4+;(4)2 Al+ Fe2O3![]() 2 Fe+ Al2O3。
2 Fe+ Al2O3。


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:
【题目】某实验室的尾气中含有较多的氯气,有毒,要吸收这些尾气,下列试剂最适合的是( )
A.Ca(OH)2 溶液
B.饱和NaCl溶液
C.自来水
D.NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】万卡特拉曼·莱马克里斯南、托马斯·施泰茨和阿达·尤纳斯三位科学家因为“核糖体的结构和功能”的研究而获得诺贝尔化学奖。核糖体含有的元素除氮、磷等元素外,一定含有的元素是( )
A. C、H、O B. C、Fe、H
C. C、H、Na D. H、O、K
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍及其化合物用途广泛。某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,以下是从该矿渣中回收NiSO4的工艺路线:
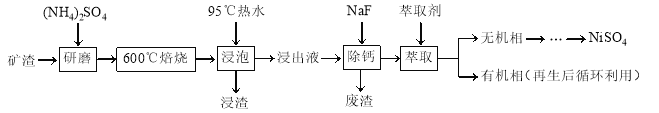
已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4。NiFe2O4在焙烧过程中生成NiSO4、Fe2(SO4)3。锡(Sn)位于第五周期第ⅣA族。
(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是______________。
(2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为______________,“浸渣”的成分除Fe2O3、FeO(OH)外还含有______________(填化学式)。
(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入SnCl2将Fe3+还原为Fe2+,所需SnCl2的物质的量不少于Fe3+物质的量的________倍;除去过量的SnCl2后,再用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,还原产物为Cr3+,滴定时反应的离子方程式为______________。
(4)“浸出液”中c(Ca2+) = 1.0×10-3mol·L-1,当除钙率达到99%时,溶液中c(F-) = ________ mol·L-1。[已知Ksp (CaF2)=4.0×10-11]
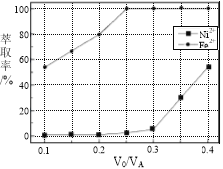
(5)本工艺中,萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知将盐酸逐滴加入Na2CO3中,发生的反应依次为:HCl+ Na2CO3= NaHCO3+NaCl, NaHCO3+HCl =NaCl+H2O+CO2↑;现将0.4gNaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能达到目的的是
A. 将蒸发皿放置在铁架台的铁圈上的石棉网加热
B. 加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铁粉
C. 用玻璃棒搅拌漏斗中的液体以加快过滤的速度
D. 加入盐酸以除去硫酸钠中的少量碳酸钠杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化钙(CaH2)固体是一种储氢材料,是登山运动员常用的能源提供剂,某化学小组的同学在老师的指导下制备氢化钙.
[查阅资料]
氢化钙通常用氢气与钙加热制得.
氢化钙要密封保存,遇水反应生成氢氧化钙和氢气.
钙遇水立即发生剧烈反应生成氢氧化钙和氢气,并放出大量的热.
标准状况下氢气的密度为0.09g/L.
[进行实验]小组同学设计的制取装置如图所示(固定装置略).

回答下列问题:
(1)写出A中发生反应的化学方程式______________________________.
(2)B、D中所盛试剂相同,该试剂为_____________,其作用分别是____________________、___________________________.
(3)实验时先打开A中活塞,一段时间后,再点燃C中酒精灯,其目的是__________________.
(4)装置C中制取氢化钙的化学方程式是______________________.
[实验反思]小组同学通过反思提出问题:上述制得的氢化钙是否纯净?
他们再次设计实验进行检验,实验步骤如下:
步骤1:检查装置气密性,装入足量的水和已称好质量的氢化钙样品,按图所示连接仪器(固定装置略).

步骤2:将Y形管倾斜,使A中的水全部进入B中,完全反应后,冷却至室温,读取量筒读数.
(5)通过上述实验可分析出制得的氢化钙是否纯净,其依据是______________________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com