
【题目】已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下:
3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O
①写出该反应的离子方程式 ______ .
②用双线桥标出该反应电子转移的方向和数目 ______ .
3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O
③若19.2g铜与足量硝酸完全反应,则消耗硝酸为 ______ mol,
被还原的硝酸为 ______ mol
生成NO的体积为 ______ L(标准状况)
【答案】 3Cu+8H+ +2 NO3-═3Cu2+ + 2NO↑+4H2O 用双线桥标出该反应电子转移的方向和数目.
3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O 0.8 mol 0.2 mol 4.48L(标准状况)
【解析】①HNO3和Cu(NO3)2 是强电解质,反应的离子方程式3Cu+8H+ +2 NO3-═3Cu2+ + 2NO↑+4H2O ;②在反应3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O中,Cu元素的化合价由0升高到+2价,N元素的化合价由+5降低为+2价,转移的电子为6e-,
则双线桥法标出电子得失的方向和数目为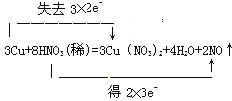
③![]() ,由方程式可知,应消耗0.8molHNO3,被还原的HNO3为0.2mol,生成NO的体积为 4.48L(标准状况)。
,由方程式可知,应消耗0.8molHNO3,被还原的HNO3为0.2mol,生成NO的体积为 4.48L(标准状况)。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、G五种短周期主族元素,原子序数依次增大,X元素的气态氢化物水溶液呈碱性;Y、M同主族,可形成MY2、MY3两种分;元素Z和G可形成1:1的离子化合物,请回答下列问题:
(1)Y在元素周期表中的位置为___________.
(2)元素Y和Z按原子个数1:1形成的化合物中存在化学键的类型_____________.
(3)能说明元素G的非金属性比元素M的非金属性强的是_________(填序号).
①最高价氧化物对应水化物的酸性:G比M强
②气态氢化物的还原性:M比G强
③气态氢化物溶于水后的酸性:G比M强
④G的最高正价比M的最高正价高
(4)M和X可形成一种化合物,其相对分子质量在170~190之间,且M的质量分数约为70%,该化合物的化学式为___________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以葡萄糖为燃料的微生物燃料电池结构示意图如图所示.关于该电池的叙述正确的是
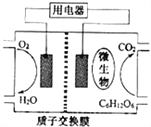
A. 该电池能够在高温下工作
B. 放电过程中,质子(H+)从正极区向负极区迁移
C. 电池的负极反应为:C6H12O6+6H2O-24e-=6CO2+24H+
D. 在电池反应中,每消耗1mol氧气,理论上能生成标准状况下CO2气体11.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016江苏卷】化合物H是合成抗心律失常药物决奈达隆的一种中间体,可通过以下方法合成:

(1)D中的含氧官能团名称为____________(写两种)。
(2)F→G的反应类型为___________。
(3)写出同时满足下列条件的C的一种同分异构体的结构简式:_________。
①能发生银镜反应;②能发生水解反应,其水解产物之一能与FeCl3溶液发生显色反应;
③分子中只有4种不同化学环境的氢。
(4)E经还原得到F,E的分子是为C14H17O3N,写出E的结构简式:___________。
(5)已知:①苯胺(![]() )易被氧化
)易被氧化
②
请以甲苯和(CH3CO)2O为原料制备 ,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2014全国大纲卷】
苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线:

制备苯乙酸的装置示意图如下(加热和夹持装置等略):

已知:苯乙酸的熔点为76.5 ℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)在250 mL三口瓶a中加入70 mL70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是
。
(2)将a中的溶液加热至100 ℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温至130 ℃继续反应。在装置中,仪器b的作用是 ;仪器c的名称是 ,其作用是 。
反应结束后加适量冷水,再分离出苯乙酸粗品。加人冷水的目的是 。下列仪器中可用于分离苯乙酸粗品的是 (填标号)。
A.分液漏斗 B.漏斗 C.烧杯 D.直形冷凝管 E.玻璃棒
(3)提纯粗苯乙酸的方法是 ,最终得到44 g纯品,则苯乙酸的产率是 。
(4)用CuCl2 2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是 。
(5)将苯乙酸加人到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1 mol/L 的某二元酸H2A的溶液中可能存在的含A粒子(H2A、HA-、A2-)的物质的量分数随pH的变化如图所示,下列说法中不正确的是

A. H2A的电离方程式为H2A![]() HA-+H+, HA-
HA-+H+, HA-![]() H++A2-
H++A2-
B. Na2A溶液一定呈碱性,NaHA溶液一定呈酸性
C. 常温下,电离常数K(HA-)=10-3
D. W点的溶液中pH=3-lg3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素A、B、C、D、E、F、G在元素周期表中的位置如图1所示。

回答下列问题:
(1)G的基态原子核外电子排布式为___________;原子的第一电离能:D_____E(填“>”或“<”)。
(2)根据价层电子对斥理论,A2C中的“A—C—A”键角是_________(填字母序号)。
A.180° B.接近120°,但小于120°
C.接近120°,但大于120 D.接近109°28ˊ,但小于109°28ˊ
(3)已知化合物G(BC)5的G元素化合价为0,熔点为-20℃,沸点为103℃,其固体属于_______晶体,该物质中存在的化学键类型有________,它在空气中燃烧生成红棕色氧化物,反应的化学方程式为_________________________。
(4)化合物BCF2的分子立体构型为________,其中B原子的杂化轨道类型是_________。写出一个与BCF2具有相同空间构型的含氧酸根离子符号_____________。
(5)化合物EC的晶胞结构如图2所示。每个晶胞中含有_______个E2+。若EC晶体的密度为dg·cm-3,阿伏伽德罗常数值为NA,则晶胞参数a=_________nm(列出计算式,不要求最终结果)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com