
【题目】将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(g) +B(g)![]() 2C(g),2 s后测得C的浓度为0.6 mol·L-1,下列说法正确的是( )
2C(g),2 s后测得C的浓度为0.6 mol·L-1,下列说法正确的是( )
A. 用物质A表示的反应平均速率为0.6 mol·L-1·s-1
B. 用物质B表示的反应的平均速率为0.3 mol·L-1·s-1
C. 2s时物质A的转化率为30%
D. 2s时物质B的浓度为0.8mol·L-1
科目:高中化学 来源: 题型:
【题目】在日常生活中,我们经常看到铁制品生锈、铝制品表面出现白斑等众多的金属腐蚀现象。可以通过下列装置所示实验进行探究。下列说法正确的是 ( )

A. 按图Ⅰ装置实验,为了更快更清晰地观察到液柱上升,可采用下列方法:用酒精灯加热具支试管
B. 图Ⅱ是图Ⅰ所示装置的原理示意图,图Ⅱ的正极材料是铁
C. 铝制品表面出现白斑可以通过图Ⅲ装置进行探究,Cl-由活性炭区向铝箔表面区迁移,并发生电极反应:2Cl--2e-=Cl2↑
D. 图Ⅲ装置的总反应为4Al+3O2+6H2O=4Al(OH)3,生成的Al(OH)3进一步脱水形成白斑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下将2 mol CO和2 mol H2O(g)充入2.0 L恒容绝热的密闭容器中,发生CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH,正反应速率和时间的关系如下图所示。下列说法正确的是( )
CO2(g)+H2(g) ΔH,正反应速率和时间的关系如下图所示。下列说法正确的是( )
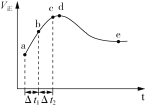
A.图中d点所示条件下,延长反应时间不能提高CO的转化率
B.反应器中的压强不变,说明反应已经达到平衡状态
C.Δt1=Δt2时,反应物的转化率:b~c段小于a~b段
D.e点CO的转化率为80%,则该温度下平衡常数为K=16
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同波长的光可以使有机化合物之间相互转化。如俘精酸酐类化合物甲、乙可以发生如下转化:
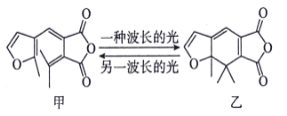
下列说法错误的是( )
A.甲与乙互为同分异构体
B.甲生成乙的反应类型为加成反应
C.甲、乙两种分子中均没有手性碳原子
D.1mol甲分子与足量NaOH溶液反应时消耗2mo1NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用纯净的CaCO3与l00mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积己折算为标准状况下的体积)。下列分析正确的是

A. EF段,用盐酸表示该反应的平均反应速率为0.4mol/(L·min)
B. OE段表示的平均速率最快
C. OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2:6:7
D. F点收集到的CO2的量最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组拟用酸性KMnO4溶液与H2C2O4溶液的反应(此反应为放热反应)来探究“条件对化学反应速率的影响”,并设计了如下的方案记录实验结果(忽略溶液混合体积变化)。限选试剂和仪器:0.20 mol/L H2C2O4溶液、0.010 mol/L KMnO4溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽。
物理量 编号 | V(0.20 mol/L H2C2O4溶液)/mL | V(蒸馏水)/mL | V(0.010 mol/L酸性KMnO4溶液)/mL | m(MnSO4)/g | T/℃ | 乙 |
① | 2.0 | 0 | 4.0 | 0 | 50 | |
② | 2.0 | 0 | 4.0 | 0 | 25 | |
③ | 1.5 | a | 4.0 | 0 | 25 | |
④ | 2.0 | 0 | 4.0 | 0.1 | 25 |