
����Ŀ��KAl(SO4)2��12H2O����������һ�ָ��Σ�����ֽ�ȷ���Ӧ�ù㷺��ʵ�����У����÷������ޣ���Ҫ�ɷ�ΪAl����������Fe��Mg���ʣ��Ʊ������Ĺ�����ͼ��ʾ���ش��������⣺

(1)����1���õ��IJ���������________________��
(2)Ϊ�������������ʣ����������ܽ�������Al(OH)3�������У���Ҫ������Ӧ�����ӷ�Ӧ����ʽΪ______________��__________________________���Լ�����_______________________________��
(3)��֪��������KW=1.0��10��14 ��Al(OH)3����NaOH��Һ��Ӧ��ƽ�ⳣ������20����Al(OH)3+H2O[Al(OH)4]��+H+ƽ�ⳣ��K=_________________��
(4)��Ȼˮ�ھ������������м�����������������ˮ�ľ�����������������______________��
(5)��ֽͨ�ŵ���Ҫ�ɷ�����ά�أ������ڵ�ֽ�������У�������ֽ����Ϳ�������Ĺ��գ�����������ף���ֹī����ɢ�����Ƿ���ֽ�Żᷢ�����Ը�ʴ����ࡢ����������вֽ������ı��档���������飬�������Ը�ʴ��Ҫ����ֽ��Ϳ�������Ĺ����йأ���˵�����ɣ�_____________________��Ϊ������Щֽ��������˽����ȡ����Zn(C2H5)2�ķ������������ˮ��Ӧ��������п�����顣�÷�Ӧ����ʽ��ʾ�÷�����������п����ֹ���Ը�ʴ��ԭ��________________________________��
���𰸡�©�����ձ��������� 2Al+2OH-+2H2O=2AlO2-+3H2�� AlO2-+HCO3-+H2O=CO32-+Al(OH)3�� K2SO4 2.0��10-13 ˮ�ľ������û��������������ȣ���ˮ�е������������������ˮ�������dz�ȥˮ�еĸ����Ӻ�þ���� ����ˮ��������Ի�������������������ά��ˮ�⣬ʹ�߷��������� Zn(C2H5)2+H2O=ZnO+2C2H6����ZnO+2H+=Zn2++H2O
��������
��������Ҫ�ɷ�ΪAl������������Fe��Mg���ʣ���ѡ��ŨNaOH�ܽ⣬�õ�ƫ��������Һ����ͨ�����˳�ȥFe��Mg�����ʣ���Һ�м���NH4HCO3��Һ�ٽ�AlO2��ˮ������Al(OH)3���������˺����ܽ���ϡ�����У��õ���������Һ������K2SO4��Һ������Ũ������ȴ�ᾧ�õ�����������
��1������1�ǹ��ˣ��õ��IJ���������©�����ձ�����������
��2��Ϊ�������������ʣ����������ܽ�������Al(OH)3�������У���Ҫ������Ӧ�����ӷ�Ӧ����ʽΪ2Al+2OH-+2H2O=2AlO2-+3H2���� AlO2-+HCO3-+H2O=CO32-+Al(OH)3����Ҫ����������Һ��ȱ�ټ����ӡ���������ӣ��Լ����� K2SO4��
��3����Al��OH��3![]() AlO2��+H��+H2O����H2O
AlO2��+H��+H2O����H2O![]() H��+OH����������KW=1.0��10��14 ����Al��OH��3+OH��
H��+OH����������KW=1.0��10��14 ����Al��OH��3+OH��![]() AlO2��+2H2O��Al(OH)3����NaOH��Һ��Ӧ��ƽ�ⳣ������20��K=20����=��+�ۣ���Al(OH)3
AlO2��+2H2O��Al(OH)3����NaOH��Һ��Ӧ��ƽ�ⳣ������20��K=20����=��+�ۣ���Al(OH)3![]() AlO2��+H��+H2O��Al(OH)3+H2O[Al(OH)4]��+H+ƽ�ⳣ��=KW��K=1.0��10��14��20=2.0��10-13��
AlO2��+H��+H2O��Al(OH)3+H2O[Al(OH)4]��+H+ƽ�ⳣ��=KW��K=1.0��10��14��20=2.0��10-13��
��4����Ȼˮ�ھ������������м�����������������ˮ�ľ�����������������ˮ�ľ������û��������������ȣ���ˮ�е������������������ˮ�������dz�ȥˮ�еĸ����Ӻ�þ���ӣ�
��5�����Ը�ʴ��Ҫ����ֽ��Ϳ�������Ĺ����йأ����ɣ�����ˮ��������Ի�������������������ά��ˮ�⣬ʹ�߷��������ѣ�Ϊ������Щֽ���������Zn(C2H5)2������ˮ��Ӧ��������п�����飬��������п����ֹ���Ը�ʴ��ԭ����Zn(C2H5)2+H2O=ZnO+2C2H6����ZnO+2H+=Zn2++H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����4 mol A�����2 mol B������2 L�������л�ϲ���һ�������·������·�Ӧ��2A(g) +B(g)![]() 2C(g)��2 s����C��Ũ��Ϊ0.6 mol��L-1������˵����ȷ���ǣ� ��
2C(g)��2 s����C��Ũ��Ϊ0.6 mol��L-1������˵����ȷ���ǣ� ��
A. ������A��ʾ�ķ�Ӧƽ������Ϊ0.6 mol��L-1��s-1
B. ������B��ʾ�ķ�Ӧ��ƽ������Ϊ0.3 mol��L-1��s-1
C. 2sʱ����A��ת����Ϊ30%
D. 2sʱ����B��Ũ��Ϊ0.8mol��L-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.100 mol��L��1 NaOH��Һ�ζ�10 mL 0.100 mol��L��1 H3PO4��Һ��������ͼ��ʾ������˵����ȷ����
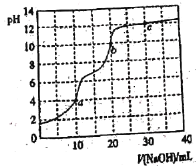
A.�ζ��յ�a��ѡ���̪��ָʾ��
B.c����Һ��c(Na��)>3c(PO43��)��2c(HPO42��)��c(H2PO4��)
C.b����Һ��c(HPO42��)>c(PO43��)>c(H2PO4��)
D.a��b��c������ˮ�ĵ���̶���С����c
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A. ʯ���ѽ�������ʹ��ˮ��ɫ��Ҳ����ʹ���������Һ��ɫ
B. ���������Ƶ�������ͭ�����Ҵ����Ƿ�����ȩ
C. ��������CH3CH2CH2OH�����Ʒ�ӦҪ��ˮ���Ʒ�Ӧ����
D. CH2=CHCH3+Cl2 ![]() CH2=CHCH2 Cl+ HCl����ȡ����Ӧ
CH2=CHCH2 Cl+ HCl����ȡ����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ����ɫ���壬���ܺ���Na2CO3��KNO3��KCl��BaCl2��CuSO4�������в���ʵ�顣
�ٽ��ù�������ˮ����ɫ��Һ��
������Һ�м���AgNO3��Һ���õ���ɫ�������ټ�������ϡHNO3����ɫ���������ܽⲢ�����ݲ�����������ͨ�����ʯ��ˮ��ʯ��ˮ����ǡ��������������жϣ�
��1��һ�����ڵ�������_______��һ�������ڵ�������________�����ܴ��ڵ�������_____________��
��2����д����ɫ���������ܽ�Ļ�ѧ����ʽ_____
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��ʵ������������β��������_____��Һ���գ��仯ѧ��Ӧ����ʽΪ_____��
��2����AlCl3��Һ����μ���NaOH��Һ���������Ȳ�����ɫ�������䷴Ӧ�����ӷ���ʽΪ_____�����ɫ�������ܽ���ʧ���䷴Ӧ�����ӷ���ʽΪ_____��
��3���ں���0.2mol�������0.2mol������Ļ����Һ200mL�У�����19.2gͭ�ۣ�����������ɷ�Ϊ_____����NO��H2��������ѡ�����ڱ�״���µ����Ϊ_____L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.6molX�����0.4molY���������ݻ�Ϊ2L�������У�ʹ�䷢�����·�Ӧ��3X��g��+Y��g��![]() nZ��g��+2W��g����5minĩ����0.2molW������֪��ZŨ�ȱ仯��ʾ��ƽ����Ӧ����Ϊ0.01mol/( L�� min)����n��ֵΪ
nZ��g��+2W��g����5minĩ����0.2molW������֪��ZŨ�ȱ仯��ʾ��ƽ����Ӧ����Ϊ0.01mol/( L�� min)����n��ֵΪ
A. 1B. 2C. 3D. 4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں����ܱ������У���CO�ϳɼ״���CO(g)+2H2(g)![]() CH3OH(g)���������������������£��о��¶ȶԷ�Ӧ��Ӱ�죬ʵ������ͼ��ʾ������˵����ȷ����
CH3OH(g)���������������������£��о��¶ȶԷ�Ӧ��Ӱ�죬ʵ������ͼ��ʾ������˵����ȷ����

A.CO�ϳɼ״��ķ�ӦΪ���ȷ�ӦB.ƽ�ⳣ��![]()
C.�÷�Ӧ��![]() ʱ��ƽ�ⳣ����
ʱ��ƽ�ⳣ����![]() ʱ��СD.����A��ķ�Ӧ��ϵ��
ʱ��СD.����A��ķ�Ӧ��ϵ��![]() �䵽
�䵽![]() ���ﵽƽ��ʱ
���ﵽƽ��ʱ![]() ����
����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1 L 0.1 mol/L�Ĵ�����Һ������ˮϡ�͵�10 L������������ȷ������������
A. c��CH3COOH����Ϊԭ����1/10
B. c��H������Ϊԭ����![]()
C. c��CH3COO����/c��CH3COOH���ı�ֵ����
D. ��Һ�ĵ�������ǿ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com