
【题目】(1)实验室制氯气的尾气处理用_____溶液吸收,其化学反应方程式为_____。
(2)向AlCl3溶液中逐滴加入NaOH溶液,现象是先产生白色沉淀,其反应的离子方程式为_____,后白色沉淀又溶解消失,其反应的离子方程式为_____。
(3)在含有0.2mol的硫酸和0.2mol的硝酸的混合溶液200mL中,加入19.2g铜粉,产生的气体成分为_____(填NO或H2),你所选气体在标准状况下的体积为_____L
【答案】NaOH 2NaOH+Cl2=NaCl+NaClO+H2O Al3++3OH﹣=Al(OH)3↓ Al(OH)3+OH﹣=AlO2﹣+2H2O NO 3.36L
【解析】
(1)实验室用氢氧化钠溶液吸收多余的氯气;
(2)铝离子和氢氧根反应生成氢氧化铝沉淀,氢氧化铝为两性氢氧化物,溶解于强碱中;
(3)硫酸和硝酸都为稀酸,反应方程式为铜与稀硝酸反应。
(1)实验室用氢氧化钠溶液吸收多余的氯气,防止污染空气;氯气和氢氧化钠反应生成氯化钠和次氯酸钠、水,反应方程式为:2NaOH+Cl2=NaCl+NaClO+H2O,
故答案为:NaOH;2NaOH+Cl2=NaCl+NaClO+H2O;
(2)向AlCl3溶液中逐滴加入NaOH溶液,现象是先产生白色沉淀,是铝离子和氢氧根反应生成氢氧化铝沉淀,离子方程式为:Al3++3OH﹣=Al(OH)3↓;后白色沉淀又溶解消失,是因为氢氧化铝为两性氢氧化物,溶解于强碱中,生成偏铝酸钠和水,离子方程式为:Al(OH)3+OH﹣=AlO2﹣+2H2O,
故答案为:Al3++3OH﹣=Al(OH)3↓;Al(OH)3+OH﹣=AlO2﹣+2H2O;
(3)0.2mol的硫酸和0.2mol的硝酸的混合溶液200mL中,硫酸和硝酸都为稀酸,加入19.2g铜粉,且氢离子不足,完全反应,设n(NO)=x,
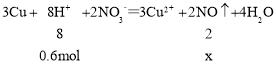
x=0.15mol,V(NO)=n×Vm=0.15×22.4=3.36L,故答案为:NO;3.36L。


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
【题目】某小组拟用酸性KMnO4溶液与H2C2O4溶液的反应(此反应为放热反应)来探究“条件对化学反应速率的影响”,并设计了如下的方案记录实验结果(忽略溶液混合体积变化)。限选试剂和仪器:0.20 mol/L H2C2O4溶液、0.010 mol/L KMnO4溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽。
物理量 编号 | V(0.20 mol/L H2C2O4溶液)/mL | V(蒸馏水)/mL | V(0.010 mol/L酸性KMnO4溶液)/mL | m(MnSO4)/g | T/℃ | 乙 |
① | 2.0 | 0 | 4.0 | 0 | 50 | |
② | 2.0 | 0 | 4.0 | 0 | 25 | |
③ | 1.5 | a | 4.0 | 0 | 25 | |
④ | 2.0 | 0 | 4.0 | 0.1 | 25 |
性质 | 原子半径 | 第一电离能 | 熔点 | 键能 |
项目 | ①Si__________C | ②C_________Si | ③CO2______SiO2 | ④H-Si_______H-C |
(2)CN-能与Fe3+形成配合物,与CN-互为等电子体的分子有_____________(任写一种);1mol[Fe(CN)6]3-中含____________mol σ键。
(3)已知:反应2CH4![]() CH2=CH2+2H2,碳原子的杂化类型转化过程为___________;
CH2=CH2+2H2,碳原子的杂化类型转化过程为___________;
(4)聚四氟乙烯是一种准晶体,准晶体是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过___________方法区分晶体、准晶体和非晶体。
(5)基态F原子的价层电子排布图为___________。
(6)[H2F]+[SbF6]-(氟锑酸)是一种超强酸,存在[H2F]+,该离子的空间构型为____________。
(7)CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃,密度为7.1g·cm-3。
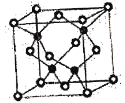
①CuF的熔点比CuCl的高,原因是____________________________________________。
②已知NA为阿伏加德罗常数的值,CuF的晶胞结构如图所示,则CuF的晶胞参数a=__________nm(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过对煤的综合利用,可以获得多种有机物。化合物A含有碳、氢、氧3种元素,其质量比是12:3:8。液态烃B是一种重要的化工原料,其摩尔质量为78 gmol-1。E是有芳香气味的酯。它们之间的转化关系如下(含有相同官能团的有机物通常具有相似的化学性质):
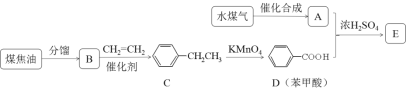
请回答:
(1)化合物A所含的官能团名称是_____________。
(2)B和CH2=CH2反应生成C的反应类型是_____________。
(3)E在氢氧化钠溶液中水解的化学方程式是_____________。
(4)下列说法正确的是_____________。
A.将铜丝在空气中灼烧后迅速插入A中,反应多次,可得到能发生银镜反应的物质
B.在一定条件下,C可通过取代反应转化为![]()
C.苯甲酸钠(常用作防腐剂)可通过D和氢氧化钠反应得到
D.共a mol的B 和D混合物在氧气中完全燃烧,消耗氧气大于7.5a mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KAl(SO4)2·12H2O(明矾)是一种复盐,在造纸等方面应用广泛。实验室中,采用废易拉罐(主要成分为Al,有少量的Fe、Mg杂质)制备明矾的过程如图所示。回答下列问题:

(1)操作1中用到的玻璃仪器有________________。
(2)为尽量少引入杂质,从易拉罐溶解至生成Al(OH)3,过程中,主要发生反应的离子反应方程式为______________,__________________________;试剂②是_______________________________。
(3)已知:常温下KW=1.0×10-14 ,Al(OH)3溶于NaOH溶液反应的平衡常数等于20。则Al(OH)3+H2O[Al(OH)4]-+H+平衡常数K=_________________。
(4)天然水在净化处理过程中加入明矾作混凝剂,水的净化和软化的区别是______________。
(5)普通纸张的主要成分是纤维素,在早期的纸张生产中,常采用纸表面涂敷明矾的工艺,以填补其表面的微孔,防止墨迹扩散。人们发现纸张会发生酸性腐蚀而变脆、破损,严重威胁纸质文物的保存。经分析检验,发现酸性腐蚀主要与造纸中涂覆明矾的工艺有关,请说明理由:_____________________;为保护这些纸质文物,有人建议采取喷洒Zn(C2H5)2的方法,其可以与水反应生成氧化锌和乙烷。用反应方程式表示该方法生成氧化锌及防止酸性腐蚀的原理________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙酮常温下为无色晶体或浅黄色油状液体,是山楂、含羞草、紫丁香等香精的调合原料,并广泛用于皂用香精和烟草香精中,可由苯经下述反应制备:
![]() +(CH3CO)2O(乙酸酐)
+(CH3CO)2O(乙酸酐) ![]() +CH3COOH, NA代表阿伏加德罗常数的值。下列有关说法正确的是
+CH3COOH, NA代表阿伏加德罗常数的值。下列有关说法正确的是
A.1 mol苯所含的化学单键数目为12NA
B.0.1 mol乙酸酐中含有的电子数目为5.4NA
C.气态苯乙酮的密度是气态乙酸密度的2倍
D.1L 2 mol·L-1 CH3COOH溶液与足量钠反应生成的气体分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将1 mol A(g)和1 mol B(g)充入2 L密闭容器中发生反应A(g)+B(g)xC(g)+D(s),在t1时达到平衡。在t2、t3时刻分别改变反应的一个条件,测得容器中C(g)的浓度随时间变化如图所示。下列有关说法正确的是

A. 反应方程式中x=2
B. t2时刻改变的条件是使用催化剂
C. t3时刻改变的条件是移去少量D
D. t1~t3间该反应的平衡常数不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mL NaOH溶液中通入一定量的CO2后,在继续向该溶液中逐滴加入0.2 mol·L-1的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如下图所示
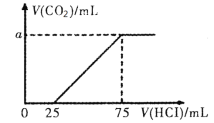
下列有关说法不正确的是
A.原溶液中NaOH的物质的量浓度为0.15 mol·L-1
B.0~25 mL发生的离子反应为:OH-+ H+ =H2O
C.通入CO2后所得的溶液中溶质的物质的量之比为1:1
D.纵坐标中a的数值为224
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫的污染臭名昭著,含硒的化学药物却有望迎来美名。某环保车间将含SO2、NO烟气经O3预处理后用CaSO3水悬浮液吸收。O3氧化烟气中SO2、NOx的主要反应的热化学方程式为
NO(g)+O3(g)=NO2(g)+O2(g) △H=-200.9 kJ·mol-1
NO(g)+1/2O2(g)=NO2(g) △H=-58.2 kJ·mol-1
SO2(g)+O3(g)=SO3(g)+O2(g) △H=-241.6kJ·mol-1
(1)实验表明,在常温下反应:3NO(g)+O3(g)=3NO2(g)正向自发,试说明原因:_____。
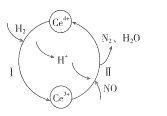
(2)将NO与H2的混合气体通入Ce(SO4)2与Ce2(SO4)3的混合溶液中,其转化过程如图所示,试写出反应I的离子反应方程式:___________,反应II的离子方程式:________________。
(3)用CaSO3水悬浮液处理二氧化氮,若在吸收液中加入Na2SO4溶液,能提高NO2的吸收速率,其主要原因是___________;达到平衡后,溶液中c(SO32-)=__________[用c(SO42-、Ksp(CaSO3)和Ksp(CaSO4)表示]。
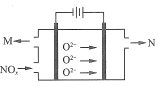
(4)氮的氧化物还可以通过电解法处理获得氮气和氧气,电解质为固体氧化物陶瓷,据图写出阴极的电极反应方程式:_______________。
(5)已知 SeO2与SO2的混合烟气用水吸收可制得单质硒,过滤得粗硒,硒的部分物理性质如下表所示。某工艺采用真空蒸馏的方法提纯获得纯硒,采用真空蒸馏的目的是_____。

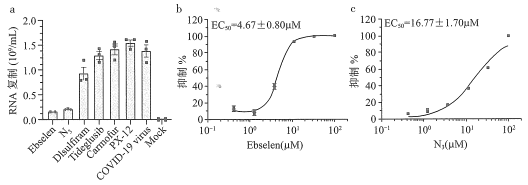
(6)最近我国学者锁定COVID-19的新靶点Mpro蛋白酶,通过先进筛选手段,在FDA批准的已上市和临床实验药物中,发现老药Ebselen(![]() )在细胞实验中展现出优异的抗病毒效果,优于此前研究者设计的多种冠状病毒Mpro蛋白酶的抑制剂N3,这两类药物都是抑制病毒的核苷酸的复制。Ebselen抑制病毒复制的最佳浓度为_____________
)在细胞实验中展现出优异的抗病毒效果,优于此前研究者设计的多种冠状病毒Mpro蛋白酶的抑制剂N3,这两类药物都是抑制病毒的核苷酸的复制。Ebselen抑制病毒复制的最佳浓度为_____________![]() ,比较N3半数有效浓度有无与伦比的优势。从影响化学反应速率的因素分析,这类药物的作用原理为_____________。
,比较N3半数有效浓度有无与伦比的优势。从影响化学反应速率的因素分析,这类药物的作用原理为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com