
【题目】向100mL NaOH溶液中通入一定量的CO2后,在继续向该溶液中逐滴加入0.2 mol·L-1的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如下图所示
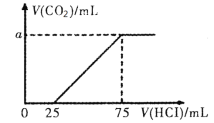
下列有关说法不正确的是
A.原溶液中NaOH的物质的量浓度为0.15 mol·L-1
B.0~25 mL发生的离子反应为:OH-+ H+ =H2O
C.通入CO2后所得的溶液中溶质的物质的量之比为1:1
D.纵坐标中a的数值为224
【答案】B
【解析】
生成CO2发生的反应为:NaHCO3+HCl=NaCl+CO2↑+H2O,假设NaOH与CO2气体反应所得溶液中只有Na2CO3,则开始阶段发生反应:Na2CO3+HCl=NaHCO3+NaCl,由方程式可知,前后两个阶段消耗盐酸的体积应相等,而实际生成二氧化碳消耗的盐酸体积多,故NaOH与CO2气体反应所得溶液中溶质为Na2CO3、NaHCO3。
A、加入100mL盐酸时二氧化碳的体积达最大,此时溶液为NaCl溶液,根据氯离子、钠离子守恒,所以n(NaOH)=n(NaCl)=n(HCl)=0.075L×0.2mol/L=0.015mol,所以c(NaOH)=![]() =0.15mol/L,故A正确;
=0.15mol/L,故A正确;
B、0~25 mL时,盐酸与Na2CO3反应生成NaHCO3,故离子方程式为:CO32﹣+H+═HCO3﹣,故B错误;
C、先发生Na2CO3+HCl=NaHCO3+NaCl,消耗25 mL盐酸,则碳酸钠的物质的量为0.025L×0.2 molL﹣1=0.005mol,生成二氧化碳发生反应NaHCO3+HCl=NaCl+CO2↑+H2O,共消耗盐酸75mL﹣20mL=50mL,n总(NaHCO3)=n(HCl)=0.05L×0.2mol/L=0.01mol,原来溶液中碳酸氢钠为0.01﹣0.005=0.005mol,所以通入CO2后所得的溶液中溶质的物质的量之比为1:1,故C正确;
D、生成二氧化碳发生反应NaHCO3+HCl=NaCl+CO2↑+H2O,共消耗盐酸75mL﹣20mL=50mL,n(CO2)=n(HCl)=0.05L×0.2mol/L=0.01mol,所以V(CO2)=0.01mol×22.4L/mol=0.224L=224mL,故D正确。
答案选B。


科目:高中化学 来源: 题型:
【题目】近期,李兰娟院士通过体外细胞实验发现抗病毒药物阿比多尔(H)能有效抑制冠状病毒,同时能显著抑制病毒对细胞的病变效应。合成阿比多尔的一条路线为:
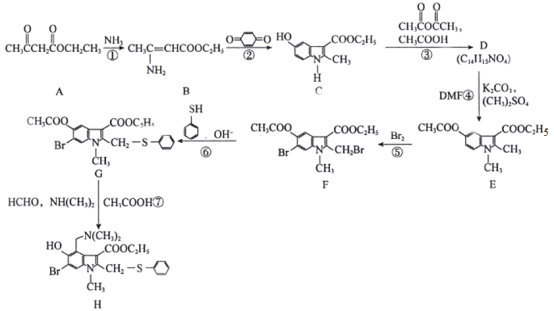
已知: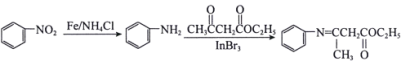 。
。
回答下列问题:
(1)阿比多尔分子中的含氧官能团为__________、____________,D的结构简式为______________。
(2)反应②的化学方程式为_______________;反应③的作用是_______________;反应⑤的类型为________________。
(3)A的同分异构体中,能发生银镜反应且能与碳酸氢钠溶液反应放出气体的有______种(不考虑立体异构)。
(4)以下为中间体D的另一条合成路线:
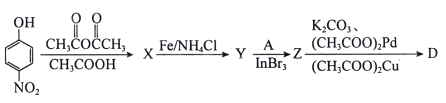
其中X、Y、Z的结构简式分别为_________、__________、_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室制氯气的尾气处理用_____溶液吸收,其化学反应方程式为_____。
(2)向AlCl3溶液中逐滴加入NaOH溶液,现象是先产生白色沉淀,其反应的离子方程式为_____,后白色沉淀又溶解消失,其反应的离子方程式为_____。
(3)在含有0.2mol的硫酸和0.2mol的硝酸的混合溶液200mL中,加入19.2g铜粉,产生的气体成分为_____(填NO或H2),你所选气体在标准状况下的体积为_____L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿混合加热发生以下反应:
Cu2S+2Cu2O=6Cu+SO2↑,关于该反应的说法中正确的是
A.该反应的氧化剂与还原剂物质的量之比为2:1
B.Cu2S 在反应中只做还原剂
C.Cu 是氧化产物,SO2是还原产物
D.每生成38.4gCu,反应中转移0.6mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,由CO合成甲醇:CO(g)+2H2(g)![]() CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是
CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是

A.CO合成甲醇的反应为吸热反应B.平衡常数![]()
C.该反应在![]() 时的平衡常数比
时的平衡常数比![]() 时的小D.处于A点的反应体系从
时的小D.处于A点的反应体系从![]() 变到
变到![]() ,达到平衡时
,达到平衡时![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲为恒压容器、乙为恒容容器。相同条件下充入等物质的量的NO2气体,且起始时体积相同。发生反应:2NO2(g)![]() N2O4(g)△H<0。一段时间后达到平衡状态,下列说法中正确的是
N2O4(g)△H<0。一段时间后达到平衡状态,下列说法中正确的是
A.该反应的平衡常数表达式K=![]()
B.达到平衡所需时间,甲与乙相等
C.平衡时NO2体积分数:甲<乙
D.若两容器内气体的压强保持不变,均说明反应已达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HClO4、H2SO4、HNO3和HCl都是强酸,它们的酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
酸 | HClO4 | H2SO4 | HCl | HNO3 |
Ka | 1.6×10-5 | 6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
下列说法中不正确的是( )
A.在冰醋酸中这四种酸都没有完全电离
B.在冰醋酸中HClO4是这四种酸中最强的酸
C.在冰醋酸中H2SO4的电离方程式为H2SO4===2H++SO![]()
D.水不能区分这四种酸的强弱,但冰醋酸可以区分这四种酸的强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有 100 mL 0.5 mol/LCa(CIO)2溶液,向其中缓慢通入CO2(如图所示)。下列说法错误的是
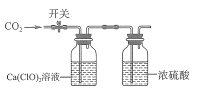
已知:①![]()
②溶液中粒子浓度可用以下公式计算:![]()
![]()
A.0.01 mol CO2通入溶液时发生反应的化学方程式为![]()
B.通入0.1 mol CO2后,用HNO3维持体系 pH=6,此时溶液中粒子浓度大小关系为c(HCO3-)>c(HCIO)>c(Ca2+)
C.迅速通入0.05 mol CO2后,关闭开关,久置后发现体系中沉淀减少
D.缓慢通入0.05 mol CO2的过程中,水的电离程度一直减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组变化中,前者小于后者的是( )
①CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH1
CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH2
②2H2(g)+O2(g)═2H2O(l) ΔH1
H2(g)+![]() O2(g)===H2O(l) ΔH2
O2(g)===H2O(l) ΔH2
③t ℃时,在一定条件下,将1 mol SO2和1 mol O2分别置于恒容和恒压的两个密闭容器中,达到平衡状态时分别反应放出的热量
④CaCO3(s)===CaO(s)+CO2(g) ΔH1
CaO(s)+H2O(l)===Ca(OH)2(s) ΔH2
A. ①②③ B. ②④ C. ②③④ D. ③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com