
| A. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 已知C(s)+$\frac{ax}{0.02}$O2(g)=CO(g)的反应热为110.5kJ/mol,说明碳的燃烧热为110.5kJ | |
| C. | 已知反应X+Y=M+N为放热反应,故不必加热就可发生 | |
| D. | 稀溶液中:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ•mol-1,若将含0.5 molH2SO4的浓溶液与含1 molNaOH的溶液混合,放出的热量大于57.3KJ |
分析 A、等质量的硫蒸气具有的能量比硫固体多;
B、燃烧热是生成稳定的氧化物,碳生成二氧化碳,而不是一氧化碳;
C、反应的热效应与反应的条件无关;
D、浓硫酸溶于水放热.
解答 解:A、等质量的硫蒸气和硫固体相比较,硫蒸气具有的能量多,因此完全燃烧硫蒸气放出的热量多,故A错误;
B、燃烧热是生成稳定的氧化物,碳生成二氧化碳,而不是一氧化碳,且单位为kJ/mol,故B错误;
C、反应的热效应与反应的条件无关,某些放热反应也需要加热才能反应,如氢气和氧气的反应,故C错误;
D、中和热是强酸强碱的稀溶液反应生成1mol水时放出的热量,浓硫酸溶于水放热,将含1molNaOH的溶液和含0.5molH2SO4的浓硫酸混合,放出的热量大于57.3 kJ,故D正确;
故选:D.
点评 本题考查了反应热量变化,热化学方程式的正误判断,物质能量与稳定性的比较方法,题目难度中等.


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:选择题
| A. | 缺少限制条件,无法测定 | B. | H+离子浓度相同 | ||
| C. | 温度低时,H+离子浓度大 | D. | 温度高时,H+离子浓度大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
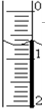 某学生用NaOH标准溶液滴定未知浓度的盐酸,进项了如下实验:
某学生用NaOH标准溶液滴定未知浓度的盐酸,进项了如下实验:| 实验次数 | 待测盐酸体积(mL) | 标准氢氧化钠溶液体积(mL) | ||
| 初读数 | 末读数 | 消耗体积 | ||
| 1 | 15.00 | 0.50 | 17.75 | 17.25 |
| 2 | 15.00 | 0.05 | 16.10 | 16.05 |
| 3 | 15.00 | 0.00 | 15.95 | 15.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子云通常是用小黑点来表示电子的多少 | |
| B. | 能量高的电子在离核近的区域运动,能量低的电子在离核远的区域运动 | |
| C. | 处于最低能量的原子叫基态原子 | |
| D. | 电子仅在激发态跃迁到基态时才会产生原子光谱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HBr、CO2、H2O、CS2 | B. | Cl2、Na2S、HCl、SO2 | ||
| C. | NaCl、HCl、H2O、NaOH | D. | Na2O2、H2O2、H2O、O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应物具有的总能量总是高于生成物所具有总能量 | |
| B. | 需要加热方能发生的反应一定是吸热反应 | |
| C. | 构成原电池的正极和负极必须是两种不同的金属 | |
| D. | 决定化学反应速率的主要因素是参加反应的物质的性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30% | B. | 37% | ||
| C. | 50% | D. | 数据不全无法计算 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com