
【题目】下列各组物质中,所含分子数相同的是
A.10gH2和10gO2 B.5.6LN2(标准状况)和11gCO2
C. 9gH2O和1molBr2 D.224mlH2(标准状况)和0.1molN2
科目:高中化学 来源: 题型:
【题目】顺式乌头酸是一种重要的食用增味剂,其结构如下图所示。下列说法正确的是
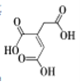
A.该有机物的分子式为:C6H8O6
B.该有机物只含有一种官能团
C.该有机物能使酸性KMnO4溶液、溴的四氯化碳溶液褪色,且原理相同
D.等物质的量的顺式乌头酸分别与足量的NaHCO3和Na反应,产生相同条件下的气体体积之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列有关说法正确的是 ( )
A. 在常温常压下,11.2LO2含有的分子数为0.5NA
B. 71gCl2所含原子数为2NA
C. 标准状况下,22.4LH2O含有的分子数为1NA
D. 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁炭混合物(铁屑和活性炭的混合物)、纳米铁粉均可用于处理水中污染物。
(1)铁炭混合物在水溶液中可形成许多微电池。将含有Cr2O72-的酸性废水通过铁炭混合物,在微电池正极上Cr2O72-转化为Cr3+,其电极反应式为_____________。
(2)在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2+和Pb2+的去除率,结果如图所示。

①当铁炭混合物中铁的质量分数为0时,也能去除水中少量的Cu2+和Pb2+,其原因是__________。
②当铁炭混合物中铁的质量分数大于50%时,随着铁的质量分数的增加,Cu2+和Pb2+的去除率不升反降,其主要原因是_____________。
(3)纳米铁粉可用于处理地下水中的污染物。
①一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH4-(B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和B(OH)4-,其离子方程式为_________。
②纳米铁粉与水中NO3-反应的离子方程式为4Fe+NO3-+10H+=4Fe2++NH4++3H2O.研究发现,若pH偏低将会导致NO3-的去除率下降,其原因是__________。
③相同条件下,纳米铁粉去除不同水样中NO3-的速率有较大差异(如下图),产生该差异的可能原因是____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】40℃时.在氮-水体系中不断通入CO2,各种离子的变化趋势如图所示。下列说法不正确的是
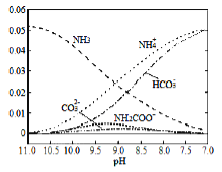
A.在pH=9.0时,c(NH4+)>c(HCO3-)>c(NH2COO-)>c(CO32-)
B.不同pH的溶液中存在关系:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-)。
C.随着CO2的通入,![]() 不断增大
不断增大
D.在溶液pH不断降低的过程中,有含NH2COO-的中间产物生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由海水制备无水氯化镁,主要有以下步骤:①在一定条件下脱水干燥;②加熟石灰;③加盐酸;④过滤;⑤浓缩结晶。其先后顺序正确的是( )
A.②④⑤③① B.③②④①⑤ C.③④②⑤① D.②④③⑤①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生产、生活密切相关,下列有关说法不正确的是
A.医用酒精是用淀粉类植物发酵经蒸馏制成,浓度通常是75%
B.福尔马林可浸制标本,利用了其使蛋白质变性的性质
C.“海水淡化”可以解决“淡水供应危机”,向海水中加入净水剂明矾可以使海水淡化
D.绚丽缤纷的烟花中添加了含钾、钠、钙、铜等金属元素的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g) △H,随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g) △H,随温度升高,混合气体的颜色变深。回答下列问题:
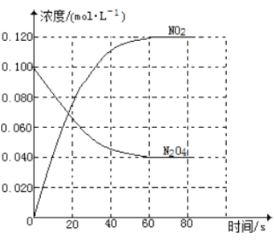
(1)反应的△H 0(填“>”或“<”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(NO2)为 mol·L-1·s-1,反应的平衡常数K为 。
(2)100℃时达平衡后,改变反应温度为T,c(N2O4)以0.0020mol·L-1·s-1的平均速率降低,经10s又达到平衡。则T 100℃(填“大于”或“小于”)。
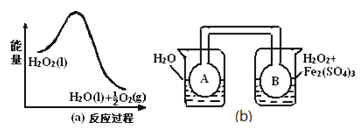
(3)利用图(a)和(b)中的信息,按图(b)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的 (填“深”或“浅”),其原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com