
【题目】已知在同温同压下,ag甲气体和2ag乙气体所占体积之比为1∶2,根据阿伏加德罗定律判断,下列叙述不正确的是
A. 同温同压下甲和乙的密度之比为1∶1
B. 甲与乙的相对分子质量之比为1∶1
C. 同温同体积下等质量的甲和乙的压强之比为1∶1
D. 等质量的甲和乙中所含原子个数之比为1∶1
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】甲乙丙丁戊是中学常见的无机物,他们的转化关系如图所示(某些条件和部分产物已略去)。下列说法错误的是

A. 若戊为一种强碱且焰色反应为黄色,则反应①②可能都属于氧化还原反应
B. 常温下,若丙为无色气体,戊为红棕色气体,则甲、乙可能是铜和稀硝酸
C. 若甲为硫磺燃烧产物,丁为水,则戊不可用于干燥甲
D. 若甲为浓盐酸,乙为MnO2,则戊可能使品红褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取100mL的Na2CO3和Na2SO4混合溶液,加入适量Ba(OH)2溶液100mL后,恰好完全反应,过滤、干燥后得到22.03g白色沉淀,再用足量的稀硝酸处理沉淀,最后减少到2.33g,并有气体放出。计算(除第一问外均要写出计算过程,没有过程不得分)
(1)写出生成2.33g沉淀的离子方程式。
(2)原混合液中Na2SO4的物质的量浓度 。
(3)产生的气体在标准状况下的体积 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 烷烃分子中一定含有极性键
B. 烷烃分子中不一定含有非极性键
C. 烷烃分子中可能含有离子键
D. 烷烃分子中的化学键都为共价单键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于固定体积的密闭容器中进行的气体反应可以说明A(g) + B(g)![]() C(g)+D(g)已达到平衡的是
C(g)+D(g)已达到平衡的是
A.反应容器的压强不随时间而变化
B.A气体和B气体的生成速率相等
C.A、B、C三种气体的生成速率相等
D.反应混合气体的密度不随时间而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)H﹣H、O = O和O﹣H键的键能分别为: a kJ/mol、b kJ/mol和c kJ/mol。CH3OH(g)的燃烧热为△H=—d kJ/mol。则CO2(g)+3H2(g) = CH3OH(g)+ H2O(l) △H= kJmol﹣1。(用含a、b、c、d的代数式表示)
(2)将CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(l)
CH3OCH3(g)+3H2O(l)
已知在某压强下,该反应在不同温度、不同投料比时,CO2的转化率如图所示。该反应的△H 0(填“>”或“<”)。若温度不变,减小反应投料比,K值将 (填“增大”、“减小”或“不变”)。
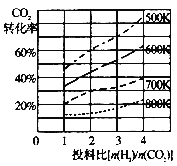
(3)某温度下,向体积一定的密闭容器中通入CO2(g)与H2(g)发生反应制备二甲醚,当下列物理量不再发生变化时,能表明上述可逆反应达到化学平衡的是 。(填字母,多选)
A.二氧化碳的浓度 B.容器中的压强
C.气体的密度 D.CH3OCH3与H2O的物质的量之比
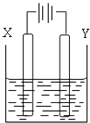
(4)以二甲醚、空气、KOH溶液组成的燃料电池为电源,以石墨为电极电解500mL滴有酚酞的NaCl溶液,如图所示,请写出该燃料电池负极反应式 。当燃料电池消耗2.8LO2(标况)时,NaCl溶液的pH= (溶液体积变化忽略)(常温)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com