
已知断开或形成1 mol化学键吸收或放出的能量称为化学键的键能,如H—H键的键能为436 kJ·mol-1,N≡N键的键能为945 kJ·mol-1,N—H键的键能为391 kJ·mol-1。则下列有关工业合成氨反应的热化学方程式正确的是 ( )
A.N2(g)+3H2(g)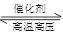 2NH3(g) ΔH=-93 kJ·mol-1 2NH3(g) ΔH=-93 kJ·mol-1 |
B.N2(g)+3H2(g)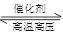 2NH3(g) ΔH=+1471 kJ·mol-1 2NH3(g) ΔH=+1471 kJ·mol-1 |
C.N2(g)+3H2(g)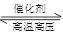 2NH3(g) ΔH=+93 kJ·mol-1 2NH3(g) ΔH=+93 kJ·mol-1 |
D.N2(g)+3H2(g)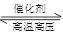 2NH3(g) ΔH=-1471 kJ·mol-1 2NH3(g) ΔH=-1471 kJ·mol-1 |
科目:高中化学 来源: 题型:单选题
下列说法正确的是:
| A.甲烷的标准燃烧热为△H=-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为 CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ·mol-1 |
| B.已知H2O(l)= H2O(g)△H="+44" kJ·mol-1, 则2gH2(g)完全燃烧生成液态水比生成气态水多释放22kJ的能量 |
| C.常温下,反应C(s)+CO2(g)=CO(g)不能自发进行,则该反应的△H <O |
| D.同温同压下,H2(g)+ Cl2 (g)="2HCl" (g)在光照和点燃条件下的△H相同。 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列图示与对应的叙述相符的是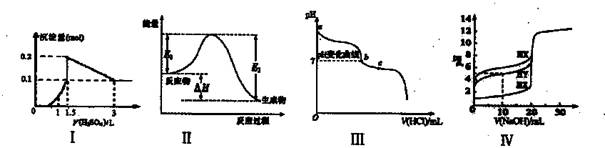
| A.图I表示向1L浓度均为0.1 mol/L的Ba(OH)2、NaAlO2混合液中逐滴加入0.1 mol/L稀H2SO4溶液,产生沉淀量的变化 |
| B.图Ⅱ中逆反应的热效应△H=E1- E2 <0,所以逆反应为放热反应 |
| C.图Ⅲ表示向20 mL 0.1 mol/L Na2CO3溶液中逐滴加入0.1 mol/L HCl溶液,溶液pH的变化,c点溶液中:c(HCO3一)+2c(CO32一)+c(C1-)>c(Na+) |
| D.用0.1 mol/L NaOH溶液分别滴定浓度相同的三种一元酸,由图Ⅳ曲线可确定HX的酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将V1 mL 1.00 mol·L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2="50" mL)。下列叙述正确的是( )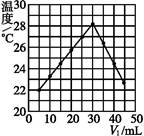
| A.做该实验时环境温度为22 ℃ |
| B.该实验表明化学能可以转化为热能 |
| C.NaOH溶液的浓度约为1.00 mol·L-1 |
| D.该实验表明有水生成的反应都是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
H2O(g)―→H2O(l)是一个放热过程,但不是化学反应,A错。HI+H2SO4(aq)=ZnSO4(aq)+H2(g) ΔH<0,则下列关于该反应的叙述不正确的是 ( )
| A.该反应中旧键断裂需吸收能量,新键形成需放出能量,所以总能量不变 |
| B.上述热化学方程式中的ΔH的值与反应物的用量无关 |
| C.该反应的化学能可以转化为电能 |
| D.反应物的总能量高于生成物的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
25 ℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ·mol-1、285.8 kJ·mol-1、890.3 kJ·mol-1、2 800 kJ·mol-1,则下列热化学方程式正确的是 ( )。
A.C(s)+ O2(g)=CO(g)ΔH=-393.5 kJ·mol-1 O2(g)=CO(g)ΔH=-393.5 kJ·mol-1 |
| B.2H2(g)+O2(g)=2H2O(g)ΔH=+571.6 kJ·mol-1 |
| C.CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=-890.3 kJ·mol-1 |
D. C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l)ΔH=-1 400 kJ·mol-1 C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l)ΔH=-1 400 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
使18g焦炭发生不完全燃烧,所得气体中CO占1/3体积,CO2占2/3体积,已知:C(s)+1/2O2(g)=CO(g);ΔH=-Q1kJ/mol;CO(g)+1/2 O2(g)=CO2(g);ΔH=-Q2 kJ/mol。与这些焦炭完全燃烧相比较,损失的热量是( )
| A.1/3Q1 kJ | B.1/3Q2 kJ | C.1/3(Q1+Q2) kJ | D.1/2Q2 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知25℃时:
①HF(aq)+OH-(aq)=F-(aq)+H2O(l) ΔH1=-67.7 kJ·mol-1
②H+(aq)+OH-(aq)=H2O(l) ΔH2=-57.3 kJ·mol-1
③Ba2+(aq)+SO42—(aq)=BaSO4(s) ΔH3<0
下列说法正确的是( )
| A.HF的电离方程式及热效应:HF(aq)=H+(aq)+F-(aq) ΔH>0 |
| B.在氢氧化钠溶液与盐酸的反应中,盐酸量一定,氢氧化钠溶液量越多,中和热越大 |
| C.ΔH2=-57.3 kJ·mol-1是强酸和强碱在稀溶液中反应生成可溶盐的中和热 |
| D.稀硫酸与稀氢氧化钡溶液反应的热化学方程式为H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l)ΔH=-114.6 kJ·mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com