
【题目】反应4A(g )+3B(g)═2C(g)+D(g),经2min B的浓度减少0.6molL﹣1 , 对此反应速率的表示正确的是( ) ①用A表示的反应速率是0.4molL﹣1min﹣1
②分别用B、C、D表示的反应速率其比值为3:2:1
③在2min末的反应速率,用B表示是0.3molL﹣1min﹣1
④在这2min内B的瞬时速率始终相等.
A.①②
B.③
C.①
D.②④
【答案】A
【解析】解:经2min,B的浓度减少0.6mol/L,v(B)= ![]() =0.3mol(Lmin)﹣1 , ①反应速率与计量数成正比,则v(A)=
=0.3mol(Lmin)﹣1 , ①反应速率与计量数成正比,则v(A)= ![]() v(B)=0.4molL﹣1min﹣1 , 故①正确;
v(B)=0.4molL﹣1min﹣1 , 故①正确;
②反应速率之比等于化学计量数之比,则分别用B、C、D表示的反应速率其比值是3:2:1,故②正确;
③反应速率为平均速率,则在2min内的反应速率,用B表示的平均速率是0.3 mol(Lmin)﹣1 , 故③错误;
④随着浓度的减小,B的瞬时速率会逐渐减小,故④错误;
故选A.
【考点精析】通过灵活运用化学平衡的计算,掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%即可以解答此题.


科目:高中化学 来源: 题型:
【题目】合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(I)、氨水]吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其反应方程式为:Cu(NH3)2Ac+CO+NH3![]() [Cu(NH3)3CO]Ac
[Cu(NH3)3CO]Ac
完成下列填空:
(1)如果要提高上述反应的反应速率,可以采取的措施是_________。(选填编号)
a.减压b.增加NH3的浓度 c.升温 d.及时移走产物
(2)铜液中的氨可吸收二氧化碳,写出该反应的化学方程式。_____________________
(3)简述铜液吸收CO及铜液再生的操作步骤(注明吸收和再生的条件)__________________。
(4)铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为___________。其中氮元素原子最外层电子排布的轨道表达式是_____________。通过比较_____________可判断氮、磷两种非金属元素的非金属性强弱。
(5)已知CS2与CO2分子结构相似,CS2的电子式是_______。醋酸二氨合铜中铜的配位数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙分别是甲烷、苯中的一种,已知:乙既不能使Br2的CCl4溶液褪色,也不能使酸性KMnO4溶液褪色;甲既不能使Br2的CCl4溶液褪色,也不能使酸性KMnO4溶液褪色,但在一定条件下可与液溴发生取代反应,且一定条件下,1 mol甲可以和3 mol H2完全加成。
(1)甲的结构简式:___________,乙的空间结构:______________________;
(2)写出乙与Cl2反应生成一氯代物的化学方程式:__________________________________________;
(3)把甲加入到盛有溴水的试管中,液体会出现分层现象,充分振荡、静置,出现橙红色液体的一层在_________(填“上”或“下”)层;
(4)在浓硫酸作用下,甲与浓硝酸反应的化学方程式:_________________________________________;
(5)等物质的量的甲、乙完全燃烧消耗O2的物质的量________________(填“甲>乙”、“甲<乙”或“甲=乙”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池的工作原理为Pb+PbO2+2H2SO4===2PbSO4+2H2O。下列判断不正确的是
A. 充电时正极的电极反应式:PbSO4+2H2O-2e-===PbO2+4H++SO![]()
B. 当电路中转移0.2 mol电子时,电池中消耗的H2SO4为0.2 mol
C. 铅蓄电池充电时SO![]() 向Pb电极迁移
向Pb电极迁移
D. 铅蓄电池充电时,铅电极应接外加电源的负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( ) 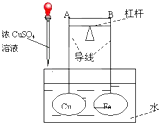
A.杠杆为导体和绝缘体时,均为A端高,B端低
B.杠杆为导体和绝缘体时,均为A端低,B端高
C.当杠杆为绝缘体时,A端低,B端高;为导体时,A端高,B端低
D.当杠杆为绝缘体时,A端高,B端低;为导体时,A端低,B端高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】早在1807年化学家戴维用电解熔融氢氧化钠制得钠:4NaOH(熔融) ![]() 4Na+O2↑+2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为3Fe+4NaOH(熔融)
4Na+O2↑+2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为3Fe+4NaOH(熔融) ![]() Fe3O4+2H2↑+4Na↑。下列有关说法正确的是
Fe3O4+2H2↑+4Na↑。下列有关说法正确的是
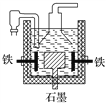
A. 电解熔融氢氧化钠制钠,阳极发生的电极反应为2OH--2e-===H2↑+O2↑
B. 盖·吕萨克法制钠原理是利用铁的还原性比钠强
C. 若戴维法与盖·吕萨克法制得等量的钠,则两反应中转移的电子总数也相同
D. 目前工业上常用电解熔融氯化钠法制钠(如上图),电解槽中石墨为阳极,铁为阴极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气态有机物X只含C、H、O三种元素,已知下列条件,现欲确定X的分子式,所需的最少条件是( )
①X中含碳质量分数 ②X中含氢质量分数 ③X在标准状况下的体积 ④质谱确定X的相对分子质量 ⑤X的质量
A.①②
B.①②④
C.①②⑤
D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种元素.原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E;D的L层电子数等于K、M两个电子层上的电子数之和.
(1)A为元素,B为元素;C为元素.D的质子数和中子数相等,D的原子组成符号为 , 它的最高价为价.
(2)用电子式表示A、D两元素形成AD2的过程: , 用电子式表示C、D两元素形成化学键的过程: .
(3)写出E和A的最高价氧化物反应的化学方程式: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com