
铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。
(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①该过程中涉及某氧化还原反应如下,请完成:
□Fe2++□ClO-+□ =□Fe(OH)3↓+□C1-+□
②检验滤液B中是否还含有铁元素的方法为:
(注明试剂、现象)。
③将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为 (填代号)。
a.氢氧化钠溶液 b.硫酸溶液 c.氨水 d.二氧化碳
④由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、冷却结晶、 (填操作名称)、洗涤。
(2)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为 (填代号)。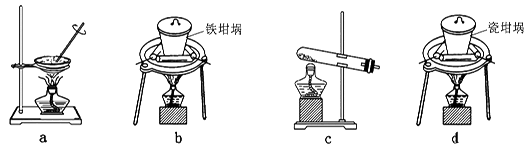
(1)①2Fe2++1ClO-+5H2O=2Fe(OH)3↓+1C1-+4H+(2分)
②取少量滤液B,加入KSCN溶液,若不变红,再加入氯水,仍然不变红,说明滤液B中不含铁元素。(其他合理答案均得分)(2分)
③ c(1分)
④过滤(1分)
(2)b(1分)
解析试题分析:(1)①根据方程式可知,铁元素的化合价从+2价升高到+3价,失去1个电子。氯元素的化合价从+1价,降低到-1价,得到2个电子,则根据电子的得失守恒可知,还原剂与氧化剂的物质的量之比是2:1。根据原子守恒与电荷守恒可知,反应前有水参加,反应后有氢离子生成,因此配平后的方程式是2Fe2++ClO-+5H2O=2Fe(OH)3↓+C1-+4H+。
②由于铁离子能和KSCN溶液发生显色反应,可以鉴别铁离子。而亚铁离子具有还原性,能被氯水氧化生成铁离子,据此可以鉴别滤液B是否含有铁元素。即取少量滤液B,加入KSCN溶液,若不变红,再加入氯水,仍然不变红,说明滤液B中不含铁元素。
③滤液B中的铝元素以Al3+的形式存在,要以沉淀形式析出,需要加入碱液。由于氢氧化铝是两性氢氧化物,所以不能选择强碱,最好选择弱碱氨水,答案选c。
④冷却结晶后有晶体析出,因此分离出晶体的实验操作应该是过滤。
(2)a是蒸发操作,不能熔融二氧化硅和氢氧化钠,a不正确;b是铁坩埚,可以熔融二氧化硅和氢氧化钠,b正确;c是试管,不能熔融二氧化硅和氢氧化钠,c不正确;d是瓷坩埚,瓷坩埚中含有二氧化硅能和氢氧化钠反应,不能熔融氢氧化钠,d不正确,答案选b。
考点:考查氧化还原反应的配平、铁元素的检验、氢氧化铝的制备以及仪器的选择等


科目:高中化学 来源: 题型:填空题
(6分)下列反应原理可以用于检查司机是否酒后开车。
K2Cr2O7+C2H5OH+H2SO4—Cr2(SO4)3+CH3COOH+K2SO4+
(1)在反应中,氧化剂是 。如果在反应中生成1molCr3+,转移电子数为 。(用NA表示阿伏加德罗常数)
(2)写出上述化学方程式所缺项(填化学式) 。
(3)乙醇(C2H5OH)和乙醚(CH3CH2OCH2CH3)的沸点分别是78.5℃、34.5℃,分离二者混合物的方法是 ,乙醇比乙醚的沸点高的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
高锰酸钾(KMnO4)是一种常用的氧化剂。
(1)有下列变化:CO32-→CO2、C2O42-→CO2、Fe3+→Fe2+,找出其中一个变化与“MnO4-→Mn2+”组成一个反应,写出该反应配平后的离子方程式____________________。
(2)不同条件下高锰酸钾可发生不同如下反应:
MnO4-+5e+8H+→Mn2++4H2O MnO4-+3e+2H2O→MnO2+4OH- MnO4-+e→MnO42-
由此可知,高锰酸根离子(MnO4-)反应后的产物与 有关。
(3)高锰酸钾可代替二氧化锰用来制取Cl2,反应中氧化剂和还原剂物质的量之比为_____________。
(4)高锰酸钾溶液与硫化亚铁在酸性条件下发生如下反应:
10FeS + 6KMnO4 + 24H2SO4 → 3K2SO4 + 6MnSO4 + 5Fe2(SO4)3 + 10S + 24H2O
若上述反应前后固体的质量减少了2.8g,则硫元素与KMnO4之间发生电子转移的数目为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究过氧化氢的性质。
请填写下列空白:
(1)移取10.00 mL密度为ρg·mL-1的过氧化氢溶液至250 mL________(填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00 mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里。 MnO4-+
MnO4-+ H2O2+
H2O2+ H+=
H+= Mn2++
Mn2++ O2+
O2+
(3)滴定时,将高锰酸钾标准溶液注入____________(填“酸式”或“碱式”)滴定管中。
如何判断滴定到达终点:
。
(4)如图表示25 mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填序号)________。
| A.是a mL | B.是(25-a)mL | C.一定大于a mL | D.一定大于(25-a)mL |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
汽车尾气产生的NO2、CO等大气污染物,可以在催化剂的作用下转化为无毒物。其反应式可表示为:2NO2 +4CO=N2 +4CO2
①用双线法标出上述反应电子转移的方向和数目:
②该反应中氧化剂是 ,还原剂是 ,每有28g N2生成,反应中转移的电子为_____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
根据反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O 回答下列问题:
(1)氧化剂是 ,氧化产物是 。
(2)氧化剂与氧化产物的物质的量比是 。
(3)当有2 mol HNO3被还原时,被氧化的物质的质量为 ,反应中转移的电子数为 ;
(4)有下列6种物质:K2SO4、K2SO3、I2、H2SO4、KIO3、H2O组成一个氧化还原反应,已知在反应中K2SO3失去电子。请回答下列问题:
将这6种物质分别填入下面对应的横线上,组成一个化学方程式(不需配平):
________+________+________ → ________+________+________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
锆(Zr)是一种重要的稀有元素。
(1)由锆英石(ZrSiO4)可制取ZrOC12-8H2O
①用碳熔炼锆英石制碳化锆的化学方程式为:ZrSiO4+3C ZrC+SiO2+2CO↑,该反应中氧化剂与还原剂的质量比为 。
ZrC+SiO2+2CO↑,该反应中氧化剂与还原剂的质量比为 。
②用烧碱熔ZrC制取Na2ZrO3,完成该反应的化学方程式:
□ZrC+□NaOH+□ 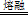 □Na2ZrO3+□CO2+□H2O
□Na2ZrO3+□CO2+□H2O
③碱熔料用盐酸浸出可得ZrOC12溶液。通过蒸发结晶从该溶液中获得ZrOC12-8H2O,还需用浓盐酸控制酸度,原因是 。
(2)ZrOC12-8H2O具有多方面的用途。用ZrOC12-8H2O和YC13制备Y2O3--ZrO2复合粉体的流程如下:
①共沉淀时,生成Zr(OH)4的化学方程式为 。
②当共沉淀恰好完全时,溶液中c(Zr4+)= 。
(已知Ksp[Zr(OH)4]=6.4×10—49,Ksp[Y(OH)3]=8.0×10—23;溶液中离子浓度为1×10-5mol?L-1时,可认为沉淀完全)
③将制得的一种复合粉体溶于水后,测得其微粒的平均直径为30 nm,该分散系属于 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
实验室模拟用工业废弃固体(含有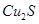 、Al2O3、Fe2O3、SiO2等)制取粗铜、绿矾(
、Al2O3、Fe2O3、SiO2等)制取粗铜、绿矾(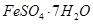 )和明矾[Kal(SO4)2
)和明矾[Kal(SO4)2 12H2O]的操作流程如下:
12H2O]的操作流程如下: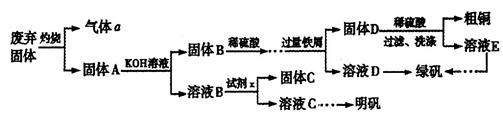
(1)试剂x是_________(写化学式)。
(2)配平下列方程式:
____
(4)为了分析产品(绿矾)中铁元素的含量,某同学称取20.0g样品配成100mL溶液,移取25.00mL用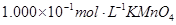 标准溶液进行滴定(MnO
标准溶液进行滴定(MnO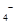 被还原为
被还原为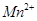 )。
)。
请回答下列问题:
①滴定时,KmnO4标准溶液应盛放在______________(填仪器名称)中。
②若达到滴定终点消耗KmnO4标准溶液体积为25.00mL,则该产品中铁元素的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(18分)为验证氧化性Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和 A中加热装置已略,气密性已检验)实验过程如下:
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是_________________________________________________。
(2)棉花中浸润的溶液为______________________。
(3)A中发生反应的化学方程式为 。
(4)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是 。
(5)能说明氧化性Fe3+>SO2的离子方程式是______________________________________。
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是 (填“甲”“乙”“丙”)。
| | 过程Ⅳ B溶液中含有的离子 | 过程Ⅵ B溶液中含有的离子 |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
 FeSO3(s)(墨绿色)
FeSO3(s)(墨绿色)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com