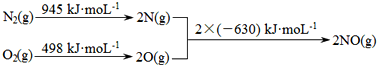���仯�������������������й㷺��Ӧ�ã��Ӵ�������������û��������Ϊԭ�ϣ�������м��㣺
��1��ij�������Ի�����Ϊԭ�ϣ��ýӴ��������ᣮ����������ʱFeS
2��������Ϊ90%��SO
2��ת����Ϊ95%��SO
3����ΪH
2SO
4ʱ�������Ϊ2%�����к�70% FeS
2�Ļ�����1 �֣�������98%������
�֣�
��2��ij����������Ϊԭ�ϣ�Ϊʹ����ȼ�գ�������һ��������ʱ���ٲ��������Ҫ��ȼ�պ��������к��������������Ϊ11%�����������������������Ϊ21%���Ҳ����Ǹ������ε�������ʧ���ʸó�����100�� 98%��������Ҫ���ı�״���¿���
m
3��
��3��ֱ���ŷź�SO
2���������γ����꣬Σ�������������Ƽ�ѭ�������ѳ������е�SO
2�����Ƽ�ѭ�����У�����500mL 0.20mol/LNaOH��Һ����SO
2�Ƶ�pH=8.2����Һ������Һ����SO
2�Ĺ����У�pH��n��SO
32-����n��HSO
3-���仯��ϵ���±���
| n��SO32-����n��HSO3-�� | 91��9 | 1��1 | 9��91 |
| pH | 8.2 | 7.2 | 6.2 |
������Һ����仯��������������̬�ĺ���������������λ��Ч���֣�
��pH=8.2ʱ��Һ��Na
2SO
3 �����ʵ���Ũ�ȣ�
�ڸ�����ҺpH��8.2�仯��6.2���������յ�SO
2�ڱ�״���µ����ԼΪ���ٺ�����
��4������ֻ��һ�ֺ�������Ĵ����Ĺ��帴�����������ⶨ���ù����к���һ�ֽ���Ԫ�غ����ַǽ���Ԫ�أ�Ϊ��һ��ȷ���ù���ɷ֣��ֽ�9.64g�ù��������ֳ����ȷݺ�����ˮ��һ�ݵμ�����KOH��Һ���ȣ������������ɫ��������ʹʪ��ĺ�ɫʯ����ֽ���������壬���������ˡ�ϴ�ӡ����գ�����Ϊ0.800g����һ�ݵμ������������ữ��BaCl
2��Һ�������İ�ɫ���������ˡ�ϴ�ӡ����գ�����Ϊ4.66g��ͨ�������ƶϸ��εĻ�ѧʽ��