
设NA为阿伏伽德罗常数的值,下列叙述正确的是
A.0.5 L 1 mol/L NaHS溶液中,N(Na+)+N(HS—)=NA
B.12.4 g白磷(分子式为P4)中含有P—P共价键0.6 NA
C.常温下,pH=2的醋酸溶液中所含有的H+数为0.01 NA
D.将92 g N2O4晶体放入容器中,恢复到常温常压时,所含气体分子数为NA
科目:高中化学 来源:2013-2014江苏省徐州市高三考前模拟化学试卷(解析版) 题型:实验题
(12分)Na2S2O3(俗称保险粉)在医药、印染中应用广泛,可通过下列方法制备:取15.1 gNa2SO3溶于80.0 mL水。另取5.0 g硫粉,用少许乙醇润湿后加到上述溶液中。小火加热至微沸,反应1小时后过滤。滤液在100℃经蒸发、浓缩、冷却至10℃后析出Na2S2O3·5H2O。
(1)加入的硫粉用乙醇润湿的目的是 。
(2)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机化合物杂质是 ;其检测的方法是:取出少许溶液,加盐酸至酸性后,过滤除去S,再加BaCl2溶液。则加入的盐酸发生两个反应的化学方程式为:
Na2SO3+2HCl=SO2↑+H2O+2NaCl; 。
(3)某环境监测小组用含0.100 mol·L-1Na2S2O3溶液[含少量的Na2SO3,且n(Na2S2O3) ∶n(Na2SO3)
= 5∶1]测定某工厂废水中Ba2+的浓度。他们取废水50.0 mL,控制适当的酸度加入足量的K2Cr2O7溶液,得BaCrO4沉淀;沉淀经洗涤、过滤后,用适量的稀硫酸溶解,此时CrO42-全部转化为Cr2O72-;再加过量KI溶液,充分反应后,用上述Na2S2O3溶液进行滴定,反应完全时,测得消耗Na2S2O3溶液的体积为36.0 mL。
(已知有关反应的离子方程式为:①Cr2O72-+6I-+14H+ 2Cr3++3I2+7H2O;
②I2+2S2O32- 2I-+S4O62-;③I2+SO32-+H2O 2I-+SO42-+2H+)
则滴定过程中可用 作指示剂。计算该工厂废水中Ba2+的物质的量浓度。
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高一下学期5月段考化学必修试卷(解析版) 题型:选择题
在硫酸铝、硫酸钾和明矾[KAl(SO4)2·12H2O]的混合溶液中,SO42—的浓度为0.4mol/L,当加入等体积0.4mol/L KOH溶液时,生成的沉淀恰好完全溶解。则反应后溶液中K+的浓度约为
A.0.225mol/L B.0.25mol/L C.0.45mol/L D.0.9mol/L
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省吴江市高二下学期期中考试化学试卷(解析版) 题型:实验题
(14分)碘溶于碘化钾溶液中形成I3—,并建立如下平衡:I3— I—+ I2。实验室可以通过氧化还原滴定法测定平衡时I3—的浓度
I—+ I2。实验室可以通过氧化还原滴定法测定平衡时I3—的浓度
实验原理:
为了测定平衡时的c(I3—) ,可用过量的碘与碘化钾溶液一起摇动,达平衡后取上层清液用标准的Na2S2O3滴定:2 Na2S2O3 + I2 = 2NaI + Na2S4O6。
由于溶液中存在I3— I— + I2的平衡,所以用硫代硫酸钠溶液滴定,最终测得的是I2和I3—的总浓度,设为c1,c1 = c(I2)+c(I3—);c(I2) 的浓度可用相同温度下,测过量碘与水平衡时溶液中碘的浓度代替,设为c2,则c(I2)= c2,c(I3—)=c1 —c2;
I— + I2的平衡,所以用硫代硫酸钠溶液滴定,最终测得的是I2和I3—的总浓度,设为c1,c1 = c(I2)+c(I3—);c(I2) 的浓度可用相同温度下,测过量碘与水平衡时溶液中碘的浓度代替,设为c2,则c(I2)= c2,c(I3—)=c1 —c2;
实验内容:
1.用一只干燥的100 mL 碘量瓶和一只250 mL碘量瓶,分别标上1、2号,用量筒取80 mL 0.0100 mol.L-1 KI于1号瓶,取200 mL 蒸馏水于2号瓶,并分别加入0.5 g过量的碘。
2.将两只碘量瓶塞好塞子,振荡30分钟,静置。
3.分别取上层清液20 mL用浓度为c mol/L标准Na2S2O3溶液进行滴定。1号瓶消耗V1 mL Na2S2O3溶液,2号瓶消耗V2 mL Na2S2O3溶液。
4.带入数据计算c(I3—)
试回答下列问题
(1)标准Na2S2O3溶液应装入 (填“酸式滴定管”或“碱式滴定管”),原因是 。
(2)碘量瓶在震荡静置时要塞紧塞子,可能的原因是
(3)滴定时向待测液中加入的指示剂是 ,到达滴定终点时的现象为 。
(4)用c 、V1 和V2 表示c(I3—)为 mol·L-1。
(5)若在测定1号瓶时,取上层清液时不小心吸入了少量的I2固体,则测定的c(I3—) (填“偏大”、“偏小”或“不变”)
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省吴江市高二下学期期中考试化学试卷(解析版) 题型:选择题
常温下,用 0.1 mol·L—1HCl溶液滴定10.0 mL浓度为0.1 mol·L—1 Na2CO3溶液,所得滴定曲线如图所示。下列说法正确的是

A.当V=0时:c(H+)+c(HCO 3-)+c(H2CO3)=c(OH-)
B.当V=5时:c(CO32—)+c(HCO 3-)+c(H2CO3)=2c(Cl-)
C.当V=10时:c(Na+)>c(HCO 3-)>c(CO32—)>c(H2CO3)
D.当V=a时:c(Na+)>c(Cl-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省吴江市高二下学期期中考试化学试卷(解析版) 题型:选择题
反应3Fe(s)+4H2O(g)  Fe3O4(s)+4H2(g)在温度和容积不变的条件下进行。下列叙述能表明反应达到平衡状态的是
Fe3O4(s)+4H2(g)在温度和容积不变的条件下进行。下列叙述能表明反应达到平衡状态的是
A.容器内压强不再改变 B.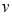 (H2O)=
(H2O)=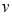 (H2)
(H2)
C.气体的密度不再改变 D.反应不再进行
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省吴江市高一下学期期中考试化学试卷(解析版) 题型:填空题
(8分)现有①BaCl2 ②金刚石 ③NH4Cl ④Na2SO4 ⑤干冰 ⑥碘 ⑦二氧化硅晶体七种物质,按下列要求回答(将物质的序号填入下列空格中):
(1)属于原子晶体的化合物是_____________。
(2)固态时属于分子晶体的是____________。
(3)熔化时需要破坏共价键的是___________,熔点最低的是___________。
(4)既含有离子键又含有共价键的是__________。
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省2013-2014学年高三模拟考试化学试卷(解析版) 题型:选择题
下列有关物质性质的应用正确的是
A.石英坩埚耐高温,可用来加热熔化NaOH固体
B.浓硫酸有脱水性,可用作干燥剂
C.二氧化硫有漂白性,可大量用于加工食品使食品漂白
D.医用酒精能使蛋白质变性,可用来消毒杀菌
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com