
(14分)碘溶于碘化钾溶液中形成I3—,并建立如下平衡:I3— I—+ I2。实验室可以通过氧化还原滴定法测定平衡时I3—的浓度
I—+ I2。实验室可以通过氧化还原滴定法测定平衡时I3—的浓度
实验原理:
为了测定平衡时的c(I3—) ,可用过量的碘与碘化钾溶液一起摇动,达平衡后取上层清液用标准的Na2S2O3滴定:2 Na2S2O3 + I2 = 2NaI + Na2S4O6。
由于溶液中存在I3— I— + I2的平衡,所以用硫代硫酸钠溶液滴定,最终测得的是I2和I3—的总浓度,设为c1,c1 = c(I2)+c(I3—);c(I2) 的浓度可用相同温度下,测过量碘与水平衡时溶液中碘的浓度代替,设为c2,则c(I2)= c2,c(I3—)=c1 —c2;
I— + I2的平衡,所以用硫代硫酸钠溶液滴定,最终测得的是I2和I3—的总浓度,设为c1,c1 = c(I2)+c(I3—);c(I2) 的浓度可用相同温度下,测过量碘与水平衡时溶液中碘的浓度代替,设为c2,则c(I2)= c2,c(I3—)=c1 —c2;
实验内容:
1.用一只干燥的100 mL 碘量瓶和一只250 mL碘量瓶,分别标上1、2号,用量筒取80 mL 0.0100 mol.L-1 KI于1号瓶,取200 mL 蒸馏水于2号瓶,并分别加入0.5 g过量的碘。
2.将两只碘量瓶塞好塞子,振荡30分钟,静置。
3.分别取上层清液20 mL用浓度为c mol/L标准Na2S2O3溶液进行滴定。1号瓶消耗V1 mL Na2S2O3溶液,2号瓶消耗V2 mL Na2S2O3溶液。
4.带入数据计算c(I3—)
试回答下列问题
(1)标准Na2S2O3溶液应装入 (填“酸式滴定管”或“碱式滴定管”),原因是 。
(2)碘量瓶在震荡静置时要塞紧塞子,可能的原因是
(3)滴定时向待测液中加入的指示剂是 ,到达滴定终点时的现象为 。
(4)用c 、V1 和V2 表示c(I3—)为 mol·L-1。
(5)若在测定1号瓶时,取上层清液时不小心吸入了少量的I2固体,则测定的c(I3—) (填“偏大”、“偏小”或“不变”)
(14分)(每空2分)(1) 碱式滴定管;Na2S2O3溶液呈碱性 (2)防止I—被空气中的氧气氧化(3) 淀粉 ;溶液恰好由蓝色变成无色,且半分钟内不褪色(4) (cV1-cV2)/40 (5)偏大
【解析】
试题分析:(1)Na2S2O3溶液是强碱弱酸盐,水解溶液显碱性,所以标准Na2S2O3溶液应装入碱式滴定管中;
(2)由于碘离子具有还原性,而空气中含有氧气,氧气能氧化碘离子,所以碘量瓶在震荡静置时要塞紧塞;
(3)由于碘遇淀粉显蓝色,所以滴定时向待测液中加入的指示剂是淀粉,到达滴定终点时的现象为溶液恰好由蓝色变成无色,且半分钟内不褪色;(4)1号瓶消耗V1mL Na2S2O3溶液,2Na2S2O3+I2=2NaI+Na2S4O6可知,20ml溶液中I2和I3-的总物质的量=1/2×V1×10-3L×c mol·L-1=0.5cV1×10-3 mol;2号瓶消耗V2mL Na2S2O3溶液,可知20mL溶液中I2的物质的量=1/2×V2×10-3L×c mol·L-1=0.5cV2×10-3 mol,
故c(I3-)=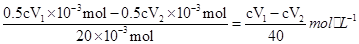 ; (5)如果取上层清液时不小心吸入了少量的I2固体,则1号瓶消耗Na2S2O3溶液的体积增加,由c(I3-)=
; (5)如果取上层清液时不小心吸入了少量的I2固体,则1号瓶消耗Na2S2O3溶液的体积增加,由c(I3-)=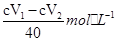 可知,测定结果偏大。
可知,测定结果偏大。
考点:氯、溴、碘及其化合物的综合应用;中和滴定;误差分析等知识。


科目:高中化学 来源:2013-2014江苏省高三模拟考试化学试卷(解析版) 题型:选择题
如图所示,装置在常温下工作(溶液体积变化忽略不计)。闭合K,灯泡发光。下列叙述中不正确的是
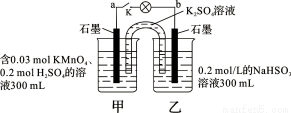
A.当电路中有1.204×1022个电子转移时,乙烧杯中溶液的pH约为1
B.电池工作时,盐桥中的K+移向甲烧杯,外电路的电子方向是从b到a
C.电池工作时,甲烧杯中由水电离出的c(H+)逐渐减小
D.乙池中的氧化产物为SO42-
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省徐州市高三第三次模拟考试化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A. 在氨水中加入少量的水或氯化铵固体后,都能使溶液中的c(OH-)减小
B. 反应Hg(l)+H2SO4(aq)===HgSO4(aq)+H2(g)在常温下不能自发进行,则ΔH<0
C. 工业电解食盐水中,电解池被阳离子交换膜隔成阴极室和阳极室,目的是避免阳极产生的气体与烧碱反应
D. 在等浓度的NaCl和Na2CrO4稀溶液中滴加AgNO3溶液,先析出AgCl沉淀,则Ksp(AgCl)<Ksp(Ag2CrO4)
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高一下学期5月段考化学必修试卷(解析版) 题型:选择题
将锌片和铜片按图示方式插入柠檬中,电流计指针发生偏转。下列针对该装置的说法正确的是
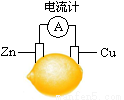
A.将电能转化为化学能
B.电子由铜片流出
C.锌片是负极.
D.铜片逐渐被腐蚀
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高一下学期5月段考化学必修试卷(解析版) 题型:选择题
在下列自然资源的开发利用中,不涉及化学变化的是
A.用蒸馏法淡化海水 B.用铁矿石冶炼铁
C.用石油裂解生成乙烯 D.用煤生产水煤气
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省吴江市高二下学期期中考试化学试卷(解析版) 题型:选择题
已知Ksp(BaSO4 )= 1.1×10-10,Ksp(BaCO3)=2.5×10-9。下列说法中不正确的是
A.BaSO4比BaCO3溶解度小,所以,BaCO3可以转化为BaSO4
B.BaCO3 、BaSO4均不溶于水,所以都可以做钡餐试剂
C.向Na2CO3溶液中加入BaCl2和Na2SO4,当两种沉淀共存时,c(SO42—)/ c(CO32—) =4.4×10-2
D.常温下,BaCO3若要在Na2SO4溶液中开始转化为BaSO4,则Na2SO4的浓度必须不低于2.2×10-6 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省吴江市高二下学期期中考试化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值,下列叙述正确的是
A.0.5 L 1 mol/L NaHS溶液中,N(Na+)+N(HS—)=NA
B.12.4 g白磷(分子式为P4)中含有P—P共价键0.6 NA
C.常温下,pH=2的醋酸溶液中所含有的H+数为0.01 NA
D.将92 g N2O4晶体放入容器中,恢复到常温常压时,所含气体分子数为NA
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省吴江市高一下学期期中考试化学试卷(解析版) 题型:选择题
在无色溶液中,下列离子能大量共存的是
A.Na+ 、NH4+ 、NO3-、MnO4- B.Mg2+、SO42-、K +、Cl-
C.K + 、Cu2+ 、Cl-、Br- D.Ba2+ 、Na+ 、OH-、HCO3-
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省2013-2014学年高三模拟考试化学试卷(解析版) 题型:实验题
(12分)工业上用铝土矿(主要成分为Al2O3,Fe2O3等)提取Al2O3做冶炼铝的原料,由熔盐电解法获得的粗铝中含一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用于钢材镀铝。工艺流程如下图所示:
(已知:NaCl熔点为801℃;AlCl3在181℃升华)
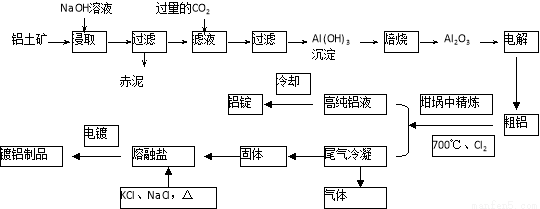
(1)向滤液中通入过量CO2所发生反应的离子方程式为 。
(2)精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,则铝和氧化铁反应的化学方程式为 。
(3)将Cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮而除去。气泡的主要成分除Cl2外还含有______。固态杂质粘附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在________。
(4)镀铝电解池中,金属铝为阳极,熔融盐电镀液中铝元素主要以AlCl4-形式存在,则阳极的电极反应式为_____________。
(5)钢材镀铝后,抗腐蚀性能会大大增强,其原因是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com