
����Ŀ��25��ʱ����һ��Ũ�ȵ�Na2X��Һ�е������ᣬ��Һ��pH������Ũ�ȱ仯��ϵ��ͼ��ʾ��

��֪��H2X�Ƕ�Ԫ���ᣬY��ʾ![]() ��
��![]() ��pY����lgY��������������ȷ���ǣ�������
��pY����lgY��������������ȷ���ǣ�������
A. ����n��ʾpH��p![]() �ı仯��ϵ
�ı仯��ϵ
B. Ka2��H2X����1.0��10��10.3
C. NaHX��Һ��c��H+����c��OH����
D. ����Һ������ʱ��c��Na+����c��HX����+2c��X2����+c��Cl����
���𰸡�C
��������
H2XΪ��Ԫ���ᣬ�Ե�һ������Ϊ������Ka1��H2X����Ka2��H2X������pH��ͬʱ![]() ��
��![]() ��pY����lgY����p
��pY����lgY����p![]() ��p
��p![]() ����m��n�ֱ��ʾpH��p
����m��n�ֱ��ʾpH��p![]() ��p
��p![]() �ı仯��ϵ��
�ı仯��ϵ��
A�����ݷ�����֪��n��ʾpH��p![]() �ı仯��ϵ����A���������⣻
�ı仯��ϵ����A���������⣻
B��M��pH��9.3��c��H+����10��9.3mol/L��p![]() ����lg
����lg![]() ��1����
��1����![]() ��0.1������Ka2��H2X����
��0.1������Ka2��H2X����![]() ��c��H+����10��9.3��0.1��1.0��10��10.3����B���������⣻
��c��H+����10��9.3��0.1��1.0��10��10.3����B���������⣻
C������B��֪HX���ĵ���ƽ�ⳣ��Ϊ1.0��10��10.3������n��ʾpH��p![]() �ı仯��ϵ��n��pH��7.4��p
�ı仯��ϵ��n��pH��7.4��p![]() ����lg
����lg![]() ����1��
����1��![]() ��10������HX����ˮ��ƽ�ⳣ��Kh��
��10������HX����ˮ��ƽ�ⳣ��Kh��![]() ��
��![]() ��
��![]() ��1.0��10��7.6��1.0��10��10.3��˵��HX����ˮ��̶ȴ��������̶ȣ���NaHX��Һ��Һ�ʼ��ԣ�c��H+����c��OH��������C�������⣻
��1.0��10��7.6��1.0��10��10.3��˵��HX����ˮ��̶ȴ��������̶ȣ���NaHX��Һ��Һ�ʼ��ԣ�c��H+����c��OH��������C�������⣻
D������Һ������ʱ��c��H+����c��OH���������ݵ���غ��֪��c��Na+����c��HX����+2c��X2����+c��Cl��������D���������⣻
�𰸣�C��


 ����ͼ���������������ϵ�д�
����ͼ���������������ϵ�д� ����ѧҵ���Ե�����ϵ�д�
����ѧҵ���Ե�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���A������ʳƷ�ӹ����л��ϳɣ���AΪԭ���Ʊ���������֬M�����;�������N�ȵĺϳ�·�����£�
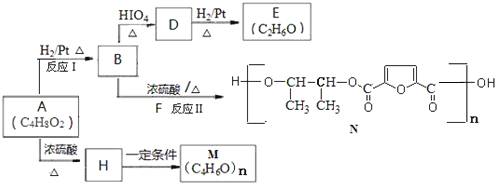
��֪��I��![]()
����R-CH�TCHOH���ȶ����ܿ�ת��ΪR-CH2-CHO
(1)A �к��еĹ���������Ϊ_______________��
(2)��Ӧ���ķ�Ӧ������_________________����д����ӦII�Ļ�ѧ����_____________________________��
(3)��ӦH��M �Ļ�ѧ����ʽ��_____________________________________________��
(4)���й���E��˵����ȷ����___________________��
a��������ˮ b������H2������ԭ��Ӧ
c���ܱ������ظ������Һ���� d����NaOH����Һ���ȷ�����ȥ��Ӧ
(5)A�����������ͬ���칹����_______�֣�����ֻ��һ������ͬ���칹��Ľṹ��ʽ��____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ҫ�ɷ��Ǽ��飩��һ�����۵���Դ����ũ���д������ڵ�ũ����ոѡ��Ӳݡ�����������������з��ͣ���ɲ���������������ȫȼ�տ���������ơ�������
��1�����������ؿ�ʵ����ͼ����ת����___��___���ڿ�����д��������ʽ����
![]()
��2����101kPaʱ��32gCH4ȼ������CO2����̬H2O���ų�1604kJ��������д������ȼ�յ��Ȼ�ѧ����ʽΪ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йظ����ԭ����������ȷ���� �� ��
A.�����ᡢ�����ʺ�������һ���������ᷴӦ��������Ӧ���������Ƕ�������������
B.����Ӥ���õ�һ����ֽ��Ƭ���õ���ˮ��ˮ�IJ��Ͽ�����![]()
C.��ϩ�;���ϩ����ʹ����![]() ��Һ��ɫ
��Һ��ɫ
D.���������������ǡ���ѿ�ǡ��������������ʵĹ�ͬ�����ǣ����Ǽȿ��Է���ˮ�ⷴӦ���ֿ��Է���������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������![]() ��ˮ��Һ���У�
��ˮ��Һ���У�
![]()
![]()
![]()
![]() ��ʾ����Ԫ����ĵ���Ҳ�Ƿֲ�����
��ʾ����Ԫ����ĵ���Ҳ�Ƿֲ�����![]()
����Һ�е��������ʵ�������![]() ��
��![]() �仯�Ĺ�ϵ��ͼ��ʾ�����������������
�仯�Ĺ�ϵ��ͼ��ʾ�����������������![]()
![]()
A.��A�����![]()
B.D����Һ�� ![]()
C.��C��Ϊ![]() ��Һ������ڣ�
��Һ������ڣ�![]()
D.��![]() ˮ��Һ�У�
ˮ��Һ�У�![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ڹ�ũҵ�����ж�����ҪӦ�á�
(1)������(N2H4)����������ĵ��⻯�
��֪��4NH3(g)��3O2(g)![]() 2N2(g)��6H2O(g)����H1����541��8 kJ��mol��1����ѧƽ�ⳣ��ΪK1��N2H4(g)��O2(g)
2N2(g)��6H2O(g)����H1����541��8 kJ��mol��1����ѧƽ�ⳣ��ΪK1��N2H4(g)��O2(g)![]() N2(g)��2H2O(g)����H2����534 kJ��mol��1����ѧƽ�ⳣ��ΪK2������NH3��O2��ȡN2H4���Ȼ�ѧ����ʽΪ__________________���÷�Ӧ�Ļ�ѧƽ�ⳣ��K��________(��K1��K2��ʾ)��
N2(g)��2H2O(g)����H2����534 kJ��mol��1����ѧƽ�ⳣ��ΪK2������NH3��O2��ȡN2H4���Ȼ�ѧ����ʽΪ__________________���÷�Ӧ�Ļ�ѧƽ�ⳣ��K��________(��K1��K2��ʾ)��
(2)����2NO(g)��2CO(g)![]() N2(g)��2CO2(g)����һ���¶��£���1 L�ĺ����ܱ������г���0��1 mol NO��0��3 mol CO����Ӧ��ʼ���С�
N2(g)��2CO2(g)����һ���¶��£���1 L�ĺ����ܱ������г���0��1 mol NO��0��3 mol CO����Ӧ��ʼ���С�
��������˵���÷�Ӧ�Ѿ��ﵽƽ��״̬����______(����ĸ����)��
A��c(CO)��c(CO2)
B�������л��������ܶȲ���
C��v(N2)����2v(NO)��
D�������л�������ƽ��Ħ����������
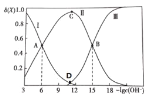
��ͼ1Ϊ�����ڵ�ѹǿ(p)����ʼѹǿ(p0)�ı�ֵ![]() ��ʱ��(t)�ı仯���ߡ�0��5min�ڣ��÷�Ӧ��ƽ����Ӧ����v(N2)��________��ƽ��ʱNO��ת����Ϊ________��
��ʱ��(t)�ı仯���ߡ�0��5min�ڣ��÷�Ӧ��ƽ����Ӧ����v(N2)��________��ƽ��ʱNO��ת����Ϊ________��
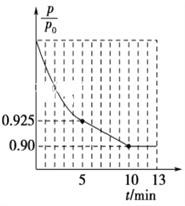
(3)ʹ�ü�ӵ绯ѧ���ɴ���ȼ�������е�NO��װ����ͼ��ʾ����֪���ص�����������Һ��pH��4��7֮�䣬д�������ĵ缫��Ӧʽ��____________________�������ӷ���ʽ��ʾ���ճ��г�ȥNO��ԭ��____________________________________________��
���𰸡� 4NH3(g)��O2(g)2N2H4(g)��2H2O(g)��H����526.2 kJ��mol��1 K1/K22 D 0��006 mol��L��1��min��1 80% 2HSO3-��2e����2H��===S2O42-��2H2O 2NO��2S2O42-��2H2O===N2��4HSO3-
��������(1)��4NH3(g)��3O2(g) ![]() 2N2(g)��6H2O(g) ��H1=��541.8kJ/mol����ѧƽ�ⳣ��ΪK1����N2H4(g)��O2(g)
2N2(g)��6H2O(g) ��H1=��541.8kJ/mol����ѧƽ�ⳣ��ΪK1����N2H4(g)��O2(g) ![]() N2(g)��2H2O(g) ��H2=��534kJ/mol����ѧƽ�ⳣ��ΪK2�����ݸ�˹���ɣ�����-����2�ã�4NH3(g)��O2(g) = 2N2H4(g)��2H2O(g) ��H=(��541.8kJ/mol)-(��534kJ/mol)��2=��526.2kJ/mol���÷�Ӧ�Ļ�ѧƽ�ⳣ��K=
N2(g)��2H2O(g) ��H2=��534kJ/mol����ѧƽ�ⳣ��ΪK2�����ݸ�˹���ɣ�����-����2�ã�4NH3(g)��O2(g) = 2N2H4(g)��2H2O(g) ��H=(��541.8kJ/mol)-(��534kJ/mol)��2=��526.2kJ/mol���÷�Ӧ�Ļ�ѧƽ�ⳣ��K=![]() ���ʴ�Ϊ��4NH3(g)��O2(g) = 2N2H4(g)��2H2O(g) ��H=��526.2kJ/mol��
���ʴ�Ϊ��4NH3(g)��O2(g) = 2N2H4(g)��2H2O(g) ��H=��526.2kJ/mol�� ![]() ��
��
(2)����2NO(g)��2CO(g) ![]() N2(g)��2CO2(g)����һ���¶��£���1L�ĺ����ܱ������г���0.1molNO��0.3molCO����Ӧ��ʼ���С�
N2(g)��2CO2(g)����һ���¶��£���1L�ĺ����ܱ������г���0.1molNO��0.3molCO����Ӧ��ʼ���С�
��A��c(CO)=c(CO2)������ʾŨ�ȱ仯�������ж��Ƿ�Ϊƽ��״̬����A����B����Ӧ��������������䣬������䣬�����л��������ܶ�ʼ�ղ��䣬�����ж��Ƿ�Ϊƽ��״̬����B����C��v(N2)��=2v(NO)����ʾ��Ӧ����2v(N2)��=v(NO)�����ű�ʾ���淴Ӧ������ȣ���C����D���÷�Ӧ������������ʵ��������仯�ķ�Ӧ�������л�������ƽ��Ħ����������ʱ��ʾ��������ʵ������䣬 ˵����ƽ��״̬����D��ȷ����ѡD��
�����������ڵ�ѹǿ(P)����ʼѹǿ(P0)�ı�ֵ(P/P0)��ʱ��(t)�ı仯���ߣ�0��5min�ڣ�![]() =0.925�����ݰ���٤�����ɼ������ۣ�
=0.925�����ݰ���٤�����ɼ������ۣ�![]() =0.925��ƽ��ʱ
=0.925��ƽ��ʱ![]() =0.90��
=0.90��
2NO(g)�� 2CO(g) ![]() N2(g)��2CO2(g)
N2(g)��2CO2(g)
��ʼ(mol) 0.1 0.3 0 0
��Ӧ 2x 2x x 2x
5min��ƽ�� 0.1-2x 0.3-2x x 2x
5minʱ��![]() =0.925�����x=0.03mol��v(N2)=
=0.925�����x=0.03mol��v(N2)=![]() = 0.006mol��L��1��min��1��ƽ��ʱ��
= 0.006mol��L��1��min��1��ƽ��ʱ��![]() =0.90�����x=0.04mol��NO��ת����=
=0.90�����x=0.04mol��NO��ת����=![]() ��100%=80%���ʴ�Ϊ��0.006 mol��L��1��min��1��80%��
��100%=80%���ʴ�Ϊ��0.006 mol��L��1��min��1��80%��
(3)����������ԭ��Ӧ����������������ӣ��õ��ӣ����������������ӣ��缫��ӦʽΪ��2HSO3-+2e-+2H+�TS2O42-+2H2O����������������һ����������������ԭ��Ӧ�����ɵ��������ӷ�Ӧ����ʽΪ��2NO+2S2O42-+2H2O�TN2+4HSO3-���ʴ�Ϊ��2HSO3-+2H++2e-=S2O42-+2H2O��2NO+2S2O42-+2H2O=N2+4HSO3-��
�����͡������
��������
10
����Ŀ������ӵ����Ŀǰ������߱������Ķ��ε�ء�LiFePO4�ɼ���ظ��Ƶ����ϵ�İ�ȫ���ܣ��Ҿ�����Դ�ḻ��ѭ���������������Ѻõ��ص㣬������ӵ���������ϵ�����ѡ������LiFePO4��һ�ֹ���������ͼ��
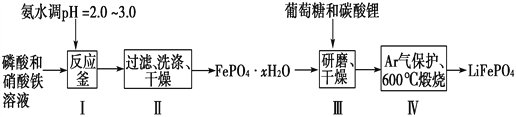
��֪��Ksp(FePO4��xH2O)��1.0��10��15��Ksp[Fe(OH)3]��4.0��10��38��
(1)�ںϳ�������ʱ���������pH�Ŀ����ǹؼ������pH<1.9��Fe3����������ȫ��Ӱ����������pH��3.0������ܴ��ڵ�������________________��
(2)������У�ϴ����Ϊ�˳�ȥFePO4��xH2O���渽�ŵ�________�����ӡ�
(3)ȡ3��FePO4��xH2O��Ʒ���������³�����ղ���ᾧˮ������ʵ���������±���
ʵ����� | 1 | 2 | 3 |
����ʧ���������� | 19.9% | 20.1% | 20.0% |
����ʧ������������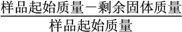 ��100%����x��_______(��ȷ��0.1)��
��100%����x��_______(��ȷ��0.1)��
(4)���������ĥ��������__________________________________��
(5)�ڲ������������LiFePO4��CO2��H2O�����������뻹ԭ�������ʵ���֮��Ϊ________��
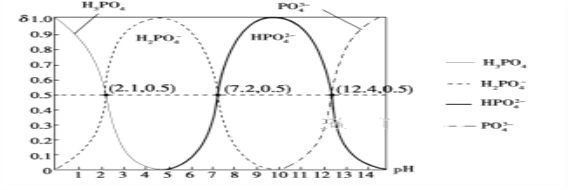
(6)H3PO4����Ԫ�ᣬ��ͼ�dz�������Һ�к����������ʵ�������(��)��pH�仯ʾ��ͼ����PO![]() ��һ��ˮ���ˮ�ⳣ��K1�ı���ʽΪ______��K1����ֵ��ӽ�______(����ĸ)��
��һ��ˮ���ˮ�ⳣ��K1�ı���ʽΪ______��K1����ֵ��ӽ�______(����ĸ)��
A��10��12.4����B��10��1.6 C��10��7.2 D��10��4.2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȫ�������ۡ�8.12����ը�¹��У���ը��������軯��й©����ɻ�����Ⱦ������ͨ������˫��ˮ�������������Һ��������
���ϣ��軯�ƻ�ѧʽNaCN(NԪ��-3��)����ɫ�ᾧ�������綾��������ˮ
��1��NaCN��˫��ˮ��������һ����ʽ�κ�һ����ʹʪ���ɫʯ����ֽ���������壬д���÷�Ӧ�Ļ�ѧ����ʽ________________��
��2��ij��ѧ��ȤС��ʵ�����Ʊ����������(Na2S2O3),������������������Һ��������軯�Ʒ�ˮ�ܷ����ŷš�
��ʵ��һ��ʵ����ͨ����ͼװ���Ʊ�Na2S2O3��
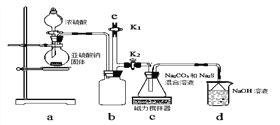
��aװ����ʢŨ���������������_______________��
bװ�õ�������________________��
��cװ���еIJ�����Na2S2O3��CO2�ȣ�dװ���е�������NaOH��Na2CO3����������___________________��
��ʵ���������e���������ʢ_________��ѡ�NaOH��Һ������ˮ������CCl4������һ�֣���ע�������ٹر�K2��K1��Ŀ����__________________
��ʵ������ⶨ�������������Һ������ķ�ˮ���軯�Ƶĺ�����
��֪��
�� ��ˮ���軯�Ƶ�����ŷű�Ϊ0.50 mg/L��
�� Ag++2CN- = [ Ag (CN)2]-, Ag++I- = AgI��, AgI�ʻ�ɫ����CN-������Ag+��Ӧ��
ʵ�����£�
ȡ25.00 mL��������軯�Ʒ�ˮ����ƿ��,���μӼ���KI��Һ��ָʾ������1.000 ��10-4 mol/L�ı�AgNO3��Һ�ζ�������AgNO3��Һ�����Ϊ2.50 mL��
�ܵζ��յ���жϷ�����____________________
�ݴ�����ķ�ˮ���軯�Ƶĺ���Ϊ__________mg/L��_______��ѡ��ܡ��������ܡ����ŷ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ũ����ͬ��NaOH��Һ��100mL����A��B��C�����ձ��У��ֱ���������Һ��ͨ�벻������CO2����ַ�Ӧ����������������Һ����μ���0.2mol/L�����ᣬ����CO2������������������֮���ϵ��ͼ��ʾ�������ж���ȷ���ǣ� ��
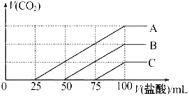
A.ԭNaOH��Һ��Ũ��Ϊ0.2mol/L
B.B�ձ���ͨ���CO2���Ϊ448mL
C.ͨ��CO2����ȷ��A�ձ��е�����
D.ͨ��CO2��C�ձ������ʳɷֵ����ʵ���֮��Ϊn(NaOH)��n(Na2CO3)��2��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�Һϳɳ���һ���»�����(��ͼ��ʾ)������W��X��Y��ZΪͬһ������Ԫ�أ�Z����������������X�����������һ�롣����������ȷ���ǣ� ��

A.WZ��ˮ��Һ�ʼ���
B.Ԫ�طǽ����Ե�˳��ΪX��Y��Z
C.Y������������ˮ������ǿ��
D.���»�������Y����8�����ȶ��ṹ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com