
【题目】某化工厂用软锰矿(含MnO2及少量Al2O3)和闪锌矿(含ZnS及少量FeS,两者均难溶于水)联合生产Zn、MnO2,其部分生产流程如图:
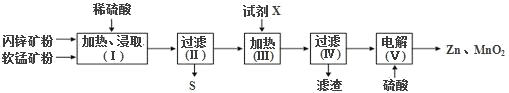
已知:过滤(Ⅱ)所得滤液是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液。
(1)加热、浸取时所加矿石均需粉碎,其目的是______。
(2)写出FeS和MnO2和稀硫酸反应的离子方程式______。
(3)试剂X的作用是调节溶液的pH以除去杂质离子,试剂X最好选用______。(填选项字母).
A.Zn2(OH)2CO3 B.Na2CO3 C.NH3·H2O
过滤IV所得滤渣的主要成分为_____。
(4)电解(Ⅴ)中阳极的电极反应式为_____。
(5)Zn和MnO2是制作电池的原料。某锌-锰碱性电池以KOH溶液为电解质溶液,其电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)。该电池的正极的电极反应式为_____。
【答案】加快反应(浸取)速率 2FeS+3MnO2+12H+=2Fe3++2S↓+3Mn2++6H2O A Fe(OH)3和Al(OH)3 Mn2+-2e-+2H2O=MnO2+4H+ 2MnO2(s)+H2O(l)+2e-=Mn2O3(s)+2OH-
【解析】
用软锰矿(含MnO2及少量Al2O3)和闪锌矿(含ZnS及少量FeS)联合生产Zn、MnO2,首先加入稀硫酸加热、浸取,过滤(Ⅱ)所得滤液主要含MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3,滤渣为二氧化锰氧化-2价的S元素得到的S单质;之后加入试剂X调节pH并加热以生成Fe(OH)3、Al(OH)3;过滤得到滤液含MnSO4、ZnSO4,加入硫酸后电解得到锌和二氧化锰,
(1)粉碎处理可以增大固体与溶液的接触面积,从而加快浸取速率;
(2)根据流程可知,酸性环境下二氧化锰将FeS氧化成Fe3+和S单质,结合电子守恒和元素守恒可得离子方程式为:2FeS+3MnO2+12H+=2Fe3++2S↓+3Mn2++6H2O;
(3)试剂X为了使溶液的pH值增大,其溶液应为碱性,且在除去Fe3+和Al3+的同时不能引入新的杂质,Na2CO3和NH3·H2O虽显碱性,但是会引入新的杂质钠离子和铵根还需要其他工艺除去,因此X最好选用Zn2(OH)2CO3,即选A,滤渣主要为Fe(OH)3和Al(OH)3;
(4)电解池中阳极发生氧化反应,根据产物Zn和MnO2可知MnO2为氧化产物,所以阳极反应为Mn2+-2e-+2H2O=MnO2+4H+;
(5)根据电极反应式Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s),可知该电池放电过程中MnO2被还原,所以正极材料为MnO2,发生还原反应,电极反应式为2MnO2(s)+H2O(l)+2e-=Mn2O3(s)+2OH-。


科目:高中化学 来源: 题型:
【题目】在容积为2.0 L的密闭容器内,物质D在T ℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述不正确的是
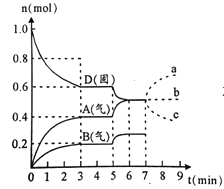
A. 从反应开始到第一次达到平衡时,A物质的平均反应速率为0.0667 mol/(L·min)
B. 该反应的化学方程式为2D(s) 2A(g)+B(g),该反应的平衡常数表达式为K=c(A)2·c(B)
C. 已知:反应的H>0,则第5分钟时图象呈现上述变化的原因可能是升高体系的温度
D. 若在第7分钟时增加D的物质的量,则表示A的物质的量变化正确的是a曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LED产品的使用为城市增添色彩。下图是氢氧燃料电池驱动LED发光的一种装置示意图。下列有关叙述正确的是( )

A.电路中的电子从负极经外电路到正极,再经过KOH溶液回到负极,形成闭合回路
B.a处通入氧气,b处通氢气
C.电池放电后,OH-的物质的量浓度减小
D.通入O2的电极发生反应:O2+4e-=2O2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列有关说法正确的是( )
A.38g3H2O2中含有3NA共价键
B.标准状况下,2.24L F2通入足量饱和食盐水中可置换出0.1NA个Cl2
C.常温下,将5.6g铁块投入足量浓硝酸中,转移0.3NA电子
D.1L 0.5mol·L1 pH=7的CH3COONH4溶液中NH4+数目为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有大量的Mg2+、Al3+、H+、Cl-和少量OH-,向该溶液中逐滴加入0.5 mol·L-1NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积之间的关系如下图所示,则可判断原溶液中( )
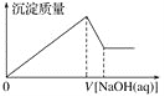
A. 有Mg2+,没有Al3+
B. 有Al3+,没有Mg2+
C. 有Mg2+和Al3+
D. 有大量的H+、Mg2+和Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个容积为2 L的密闭容器中,加入0.8 mol的A2气体和0.6 mol B2气体,一定条件下发生如下反应:A2(g)+B2(g)![]() 2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是
2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是

A. 图中a点的值为0.15 B. 该反应的平衡常数K=0.03
C. 温度升高,平衡常数K值减小 D. 平衡时A2的转化率为62.5%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏伽德罗常数的值,下列说法正确的是( )
A.8.4g乙烯和丙烯混合气体中含C-H键个数为1.2NA个
B.盛有NO2的密闭容器在含有NA个氧原子,则NO2的物质的量是0.5mol
C.标准状况下,22.4L二氯甲烷的分子数为NA个
D.电解精炼铜时,若阳极质量减少64g,则阴极得电子数为2NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种微生物燃料电池的结构示意图如下所示,关于该电池的叙述正确的是( )
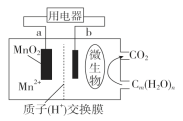
A. 电池工作时,电子由a流向b
B. 微生物所在电极区放电时发生还原反应
C. 放电过程中,H+从正极区移向负极区
D. 正极反应式为:MnO2+4H++2e-===Mn2++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是短周期主族元素,且原子序数依次增大。在短周期中A元素原子半径最小,D元素原子半径最大,B的简单氢化物的水溶液呈碱性,C、E同主族,形成的化合物为![]() 、
、![]() 。回答下列问题:
。回答下列问题:
![]() 在元素周期表中的位置为_______。
在元素周期表中的位置为_______。
![]() 比较B与C简单氢化物的热稳定性:_____>____。
比较B与C简单氢化物的热稳定性:_____>____。![]() 填化学式
填化学式![]()
![]() ,C两元素组成的化合物
,C两元素组成的化合物![]() 与水反应的化学方程式为__________
与水反应的化学方程式为__________
![]() 写出实验室制取BA3的化学方程式__________
写出实验室制取BA3的化学方程式__________
(5)实验室检验BA3的方法_________
(6)D、F的最高价氧化物的水化物酸性较强的是_________(用化学式表示)
(7)用电子式表示![]() _________
_________![]() _____________
_____________
(8)下列说法正确的是__________
A.元素F形成的单质比元素E形成的单质的熔点低
B.F和E两元素的简单氢化物受热分解,前者的分解温度高
C.![]() 通入到
通入到![]() 的溶液中出现浑浊
的溶液中出现浑浊
D.F氢化物的酸性比E氢化物的酸性强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com