
【题目】某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示.
①由图中的数据分析,该反应的化学方程式为 .
② 反应开始至2min、5minZ的平均反应速率为、 .
③ 5min后Z的生成速率比5min末Z的生成速率(大、小、相等).
【答案】3X+Y?2Z;0.05mol?(L?min)﹣1;0.04mol?(L?min)﹣1;相等
【解析】(1)由图象可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,且△n(X):△n(Y):△n(Z)=0.6mol:0.2mol:0.4mol=3:1:2,则反应的化学方程式为3X+Y ![]() 2Z,所以答案是:3X+Y
2Z,所以答案是:3X+Y ![]() 2Z;(2)反应开始至2min时的平均反应速率为:
2Z;(2)反应开始至2min时的平均反应速率为: ![]() =0.05mol/(Lmin),5min时Z的平均反应速率v=
=0.05mol/(Lmin),5min时Z的平均反应速率v=![]() =0.04mol(Lmin)﹣1 , 所以答案是:0.05mol(Lmin)﹣1;0.04mol(Lmin)﹣1;(3)5min时,化学反应达到了平衡状态,正逆反应速率相等,所以答案是:相等.
=0.04mol(Lmin)﹣1 , 所以答案是:0.05mol(Lmin)﹣1;0.04mol(Lmin)﹣1;(3)5min时,化学反应达到了平衡状态,正逆反应速率相等,所以答案是:相等.
【考点精析】解答此题的关键在于理解反应速率的定量表示方法的相关知识,掌握反应速率的单位:mol/(L·min)或mol/(L·s) v=△c-△t.


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】下列各组物质中,分子数相同的是( )
A. 2 L SO2和2 L CO2 B. 9 g水和标准状况下11.2 L CO2
C. 标准状况下1 mol氧气和22.4 L水 D. 0.1 mol氢气和2.24 L氯化氢气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀.甲同学认为沉淀可能是CuCO3;乙同学认为沉淀可能是Cu(OH)2;丙同学认为沉淀可能是CuCO3和Cu(OH)2的混合物.(查阅资料知:CuCO3和Cu(OH)2均不带结晶水) 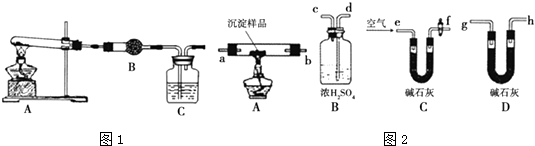
(1)Ⅰ.在探究沉淀成分前,须将沉淀从溶液中分离并净化.其具体操作依次为 . 用如图1所示装置,选择必要的试剂,定性探究生成物的成分.
(2)B中试剂为 .
(3)能证明生成物中有CuCO3的实验现象是 .
(4)Ⅱ.若CuCO3和Cu(OH)2两者都有,可利用下列装置如图2通过实验测定其组成.
实验开始和结束时都要通入过量的空气,请说明结束时通入过量空气的作用是 .
(5)各装置连接顺序为 e→→h.(填字母序号)
(6)若沉淀样品的质量为m克,装置B质量增加了n克,则沉淀中CuCO3的质量分数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近我国科研人员成功攻克了5G通信芯片制造中关键材料—氮化镓的研制难题。已知元素镓(Ga)与Al同主族,氮化镓中镓显最高正价,氮显最低负价。则氮化镓的化学式为
A. GaNB. GaN2C. Ga2N3D. Ga3N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)如图所示的装置在实验室中用途比较广泛:
①排空气法收集气体,若收集CO2气体,进气口为 (填“a”或“b”)。
②若瓶中装满水,可用于收集下列气体中的(选填编号)。
A、NO B、NO2 C、NH3 D、HCl
此时进气口为(填“a”或“b”)。
③如果广口瓶中盛放浓硫酸,可用作气体干燥装置,则该装置不可以干燥的气体有(选填编号)。
A、HCl B、NH3 C、H2 D、CO
④此装置还可用于除去气体中的杂质气体。若要用此装置除去CO2中混有的少量SO2气体,则装置中应盛放的液体可能是(选填编号)。
A、NaOH溶液 B、饱和Na2CO3溶液 C、饱和NaHCO3溶液 D、浓H2SO4
(2)下面是中学化学实验中常见的几种仪器:
A.量筒 B.容量瓶 C.试管 D.圆底烧瓶 E.托盘天平
①其中仪器上要标出使用温度的是(填选项)
②可用作反应容器并能进行加热的是(填选项)
③下列操作,使得实验结果偏小的是(填选项)
A.称取5.2 gNaCl固体时,将砝码放在左盘,NaCl固体放在右盘
B.配制一定物质的量浓度的NaCl溶液,转移NaCl溶液前,容量瓶中已有少许蒸馏水
C. 配制一定物质的量浓度的NaCl溶液,定容时俯视读数。
D.用量筒量取一定体积的浓硫酸,浓硫酸倒入烧杯后,用蒸馏水继续冲洗量筒内壁并将洗涤液倒入烧杯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组为探究铁与浓硫酸的反应,设计了图1、图2所示装置进行实验。
(1)比较两实验装置,图2装置的优点是:
①能更好地吸收有毒气体SO2 , 防止其污染环境;②。
(2)导气管e有两个主要作用:一是在反应过程中,因导管插入液面下,可起到“液封”作用阻值SO2 气体逸出而防止污染环境;二是。
(3)能说明有SO2气体产生的实验现象是。
(4)反应一段时间后,用滴管吸取A试管中的溶液滴入适量水中为试样,试样中所含金属离子的成分有 以下三种可能:
I:只含有Fe3+;Ⅱ:只含有Fe2+;Ⅲ:既有Fe3+又有Fe2+。
为验证Ⅱ、Ⅲ的可能性,选用如下试剂,填写下列空格:
A 稀HCl溶液 B 稀硫酸 C KSCN溶液 D KMnO4溶液
E NaOH溶液 F 淀粉KI溶液 G H2O2溶液
验证Ⅱ:取试样,先滴加少量的(填试剂序号,下同),振荡,再滴加少量的 , 根据溶液颜色的变化可确定假设Ⅱ是否正确。
验证Ⅲ:步骤1.取试样,滴加少量的(填试剂序号,溶液的颜色变色,则试样中含有Fe3+ , 发生反应的离子方程式为;
步骤2.再取适量的试样,滴加少量的(填试剂序号),溶液颜色的变化为 , 则试样中含有Fe2+。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为2L密闭容器中加入反应物A、B,发生如下反应:A+2B=3C.经2min后,A的浓度从开始时的1.0molL﹣1 降到0.8molL﹣1 . 已知反应开始时B的浓度是1.2molL﹣1 . 则:2min末B的浓度mol/L , C的物质的量mol . 2min内,用A物质的浓度变化来表示该反应的反应速率,即V(A)=mol/(L.min) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)2Z(g),此反应达到平衡的标志是( )
A.容器内气体密度不随时间变化
B.v(X):v(Y)=1:2
C.容器内X、Y、Z的浓度不随时间变化
D.单位时间消耗0.1molX同时生成0.2molZ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入5mol/L的NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示. 
(1)加入NaOH0~20mL 时发生反应离子方程式 , 加入NaOH20~200mL 时发生反应离子方程式 , 加入NaOH200~240mL 时发生反应离子方程式 ,
(2)镁和铝的总质量为g
(3)硫酸的物质的量浓度为mol/L
(4)生成的氢气在标准状况下的体积为L.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com