
【题目】某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀.甲同学认为沉淀可能是CuCO3;乙同学认为沉淀可能是Cu(OH)2;丙同学认为沉淀可能是CuCO3和Cu(OH)2的混合物.(查阅资料知:CuCO3和Cu(OH)2均不带结晶水) 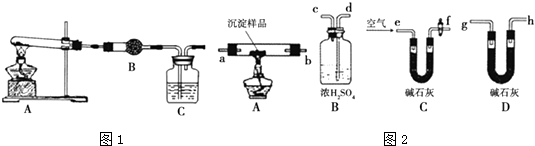
(1)Ⅰ.在探究沉淀成分前,须将沉淀从溶液中分离并净化.其具体操作依次为 . 用如图1所示装置,选择必要的试剂,定性探究生成物的成分.
(2)B中试剂为 .
(3)能证明生成物中有CuCO3的实验现象是 .
(4)Ⅱ.若CuCO3和Cu(OH)2两者都有,可利用下列装置如图2通过实验测定其组成.
实验开始和结束时都要通入过量的空气,请说明结束时通入过量空气的作用是 .
(5)各装置连接顺序为 e→→h.(填字母序号)
(6)若沉淀样品的质量为m克,装置B质量增加了n克,则沉淀中CuCO3的质量分数为 .
【答案】
(1)过滤、洗涤、干燥
(2)无水硫酸铜固体
(3)装置C中澄清石灰水变混浊
(4)将装置中滞留的气体赶出,使其充分被吸收
(5)f→a→b→d→c→g
(6)(1﹣ ![]() )×100%
)×100%
【解析】解:Ⅰ、(1.)在探究沉淀成分前,须将沉淀从溶液中分离并净化.其具体操作依次为过滤、洗涤、干燥,定性探究生成物的成分,所以答案是:过滤、洗涤、干燥;
(2.)利用加热的方法检验,氢氧化铜和碳酸铜加热分解得到氧化铜、水和二氧化碳,若有氢氧化铜可用无水硫酸铜检验,若有碳酸铜可用澄清的石灰水检验产生的二氧化碳,所以答案是:无水硫酸铜固体;
(3.)用澄清的石灰水检验是否产生二氧化碳,装置C中澄清石灰水变浑浊,说明生成二氧化碳,即说明含有CuCO3 . 所以答案是:装置C中澄清石灰水变混浊;
(4.)Ⅱ、实验开始时装置的空气中会有水蒸气和二氧化碳,若不排除被吸收装置吸收会对计算结果产生较大的误差,故开始时先用除去水和二氧化碳的空气将装置中的水蒸气和二氧化碳排除,故装置C中碱石灰的作用是吸收空气中的H2O 蒸汽和CO2 , 氢氧化铜和碳酸铜加热分解后会在反应装置中残留二氧化碳和水蒸气,通过用除去水和二氧化碳的空气将装置中的水蒸气和二氧化碳赶出被吸收装置完全吸收,防止影响测定结果,
所以答案是:将装置中滞留的气体赶出,使其充分被吸收;
(5.)若CuCO3和Cu(OH)2两种沉淀都有,加热时生成CO2和H2O,定量检验时,可用浓硫酸吸收水,用碱石灰吸收二氧化碳,实验时,为减小误差,应排除空气中水和二氧化碳的干扰,并保证水和二氧化碳完全吸收,则实验仪器的连接顺序应为e→f→a→b→d→c→g→h→j,
所以答案是:f→a→b→d→c→g;
(6.)装置B质量增加了n克,说明分解生成ng水,水的物质的量为 ![]() mol,根据氢元素守恒可知氢氧化铜的物质的量为
mol,根据氢元素守恒可知氢氧化铜的物质的量为 ![]() mol,故氢氧化铜的质量为
mol,故氢氧化铜的质量为 ![]() mol×98g/mol=
mol×98g/mol= ![]() g,沉淀中CuCO3的质量为(m﹣
g,沉淀中CuCO3的质量为(m﹣ ![]() )g,碳酸铜的质量分数为=
)g,碳酸铜的质量分数为= ![]() ×100%=(1﹣
×100%=(1﹣ ![]() )×100%,
)×100%,
所以答案是:(1﹣ ![]() )×100%.
)×100%.


科目:高中化学 来源: 题型:
【题目】铜是生物体必需的微量元素,也是人类最早使用的金属之一。铜的生产和使用对国计民生各个方面都产生了深远的影响。
(1)为了保护环境和节约资源,通常先用H2O2和稀硫酸的混合溶液溶出废旧印刷电路板中的铜,最终实现铜的回收利用。写出H2O2和稀硫酸的混合溶液与金属铜反应的离子方程式:。
(2)工业上以黄铜矿为原料,采用火法熔炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+Cu2S ![]() 6Cu+SO2↑,该反应的氧化剂是;当生成19.2 g Cu 时,反应中转移的电子为 mol。
6Cu+SO2↑,该反应的氧化剂是;当生成19.2 g Cu 时,反应中转移的电子为 mol。
(3)研究性学习小组用“间接碘量法”测定某试样中CuSO4·5H2O(不含能与I-反应的氧化性杂质)的含量。称取a g试样配成 100 mL 溶液,取出25.00 mL溶液,向其中滴加 KI 溶液后有白色沉淀生成(发生的反应为2Cu2++4I-=2CuI↓+I2);继续滴加 KI 溶液至沉淀不再产生,反应生成的 I2 与V mL c mol·L-1Na2S2O3溶液恰好完全反应(发生的反应为I2+2Na2S2O3=2NaI+Na2S4O6)。则试样中CuSO4·5H2O的质量分数为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应:2A+3B2C.开始时C的浓度为a molL﹣1 , 2min后C的浓度变为2a molL﹣1 , A和B的物质的量浓度均变为原来的 ![]() ,则下列说法中不正确的是( )
,则下列说法中不正确的是( )
A.用B表示的反应速率是0.75a mol/(Lmin)
B.反应开始时,c(B)=3a molL﹣1
C.反应2min后,c(A)=0.5a molL﹣1
D.反应2min后,c(B)=1.5a molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图像如图所示。下列说法正确的是( )
A.原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+
B.原溶液中一定含有SO42-和Na+
C.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1
D.反应最后形成的溶液中含有的溶质为Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.56g Cu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12L(标准状况),则反应中消耗HNO3的物质的量为( )
A.0.05 mol
B.1 mol
C.1.05 mol
D.0.13 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示.
①由图中的数据分析,该反应的化学方程式为 .
② 反应开始至2min、5minZ的平均反应速率为、 .
③ 5min后Z的生成速率比5min末Z的生成速率(大、小、相等).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在101 kPa和25 ℃时,热化学方程式:H2(g) + 1/2O2(g) =H2O(g)△H=-241.8 kJ/mol,H2(g) + 1/2O2(g) =H2O(1);△H=-285.8 kJ/mol。下列说法中错误的是
A.H2燃烧生成1 mol H2O(g)时,放出241.8 kJ的热量
B.H2的燃烧热为285.8 kJ
C.O2前面的1/2表示参加反应的O2的物质的量
D.1 mol液态水变成水蒸气时吸收44 kJ的热量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com