
分析 因Ag+只能与NO3-共存,Al3+、Fe2+只能与Cl-、SO42-共存,剩余的K+、Ba2+只能与形成K2CO3、Ba(OH)2,测得A、C溶液呈碱性,且A大于C,则A为Ba(OH)2,C为K2CO3,B与D混合无现象,可知E为AgNO3,D与A反应,为Ba(OH)2与AlCl3反应,以此来解答.
解答 解:因Ag+只能与NO3-共存,Al3+、Fe2+只能与Cl-、SO42-共存,剩余的K+、Ba2+只能与形成K2CO3、Ba(OH)2,测得A、C溶液呈碱性,且A大于C,则A为Ba(OH)2,C为K2CO3,B与D混合无现象,可知E为AgNO3,D与A反应,为Ba(OH)2与AlCl3反应,则D为AlCl3,B为FeSO4,
(1)由上述分析可知,不做实验可确定AgNO3、K2CO3、Ba(OH)2,故答案为:3;
(2)测得A、C溶液呈碱性,且A大于C,因A为强碱,C水解显碱性,C为K2CO3,故答案为:K2CO3;
(3)将1 mol•L-1B溶液和1 mol•L-1 D溶液混合无明显现象,Al3+、Fe2+、Cl-、SO42-之间不反应,可知E为AgNO3,故答案为:E;AgNO3;
(4)100 mL 0.1 mol•L-1 D溶液与200 mL 0.1 mol•L-1A溶液混合,生成白色沉淀,充分振荡后最终无沉淀,则D的化学式为AlCl3,该反应的离子方程式为Al3++4OH-=AlO2-+2H2O,故答案为:AlCl3;Al3++4OH-=AlO2-+2H2O.
点评 本题以离子反应为载体考查无机物的推断,为高频考点,把握离子之间的反应、现象等为解答的关键,侧重分析与推断能力的考查,注意水解及白色沉淀的判断,题目难度不大.


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:解答题
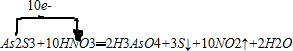 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
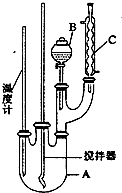 实验室制备硝基苯的反应原理和实验装置如下:
实验室制备硝基苯的反应原理和实验装置如下: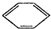 +HO-NO2$→_{50-60℃}^{H_{2}SO_{4}}$
+HO-NO2$→_{50-60℃}^{H_{2}SO_{4}}$ NO2+H2O△H<0
NO2+H2O△H<0| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 间二销基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸 | 83 | 1.4 | 易溶于 | |
| 浓硫酸 | 338 | 1.84 | 易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
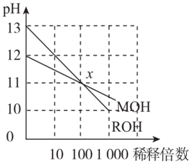
| A. | ROH是一种强碱,MOH是一种弱碱 | |
| B. | 等浓度的MOH与盐酸反应,所得溶液呈中性,则V(MOH)>V(盐酸) | |
| C. | 在x点,c(M+)=c(R+) | |
| D. | 稀释前,c(ROH)=10c(MOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
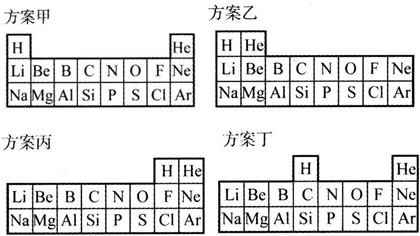
| “合理”的理由 | |
| 方案甲 | |
| 方案乙 | |
| 方案丙 | |
| 方案丁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属表面的氧化膜都很致密,能对金属起到保护作用 | |
| B. | 金属表面的氧化膜的形成都需要金属暴露在空气中很长时间才会形成 | |
| C. | 金属表面的氧化膜薄层的厚度会随着金属暴露在空气中的时间增长而加厚 | |
| D. | 某些金属表面氧化膜的形成对这些金属的广泛应用起到关键作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在相同条件下的溶解度:NaHCO3>Na2CO3 | |
| B. | 热稳定性:HF>HCl>HBr>HI | |
| C. | 氧化性:F2>Cl2>Br2>I2 | |
| D. | 碳酸钠溶液与稀盐酸互滴时,两种操作现象不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
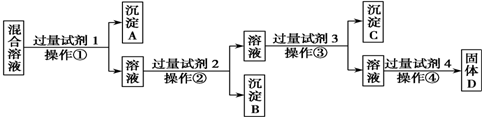
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com