
(1)请回答下列问题:
①已知:①CO(g) + 1/2O2(g) = CO2(g) △H= -283.0kJ·mol-1
②CH3OH(l) + 3/2O2(g) = CO2(g)+2H2O(l) △H= -726.5kJ·mol-1
请写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:____________________________________________________________________;
②已知拆开1molH-H键、1molCl-Cl键、1molH—Cl键分别需要的能量是436kJ、243kJ、432kJ,则反应则反应:H2(g)+ Cl2(g)=2HCl (g) 的△H= 。
(2)已知25℃、101 kPa下,稀的强酸与稀的强碱溶液反应的中和热为 -57.3 kJ/mol。
①则表示稀硫酸与稀烧碱溶液中和反应的热化学方程式为: 。
②测定中和热实验时所需的玻璃仪器有烧杯、量筒、 、 。
(1)①(3分) CH3OH(l) + O2(g) === CO(g)+2H2O(l) △H=-443.5kJ·mol-1 (不标状态、化学式错0分;化学式和状态正确1分,条件和系数1分,反应热1分)
②(2分)-185kJ/mol(数值1分,单位1分)
(2)①(3分)1/2H2SO4(aq)+NaOH(aq)=1/2Na2SO4(aq)+H2O(l) ΔH =﹣57.3 kJ/mol (不标状态、化学式错0分;化学式和状态正确1分,条件和系数1分,反应热1分)
②(2分)温度计 环形玻璃搅拌棒(顺序颠倒也可)
解析试题分析:(1)②用键能来表示反应热的话,是用反应物的键能总和减去生成物的键能总和。(2)①中和热的热化学方程式是表示生成1 mol水的时候所放出的热量,要注意与热化学方程式的区别。
考点:考查反应热的有关知识。


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源: 题型:填空题
甲烷作为一种新能源在化学领域应用广泛,请回答下列问题。
(1)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=260 kJ·mol-1
已知:2CO(g)+O2(g)===2CO2(g)
ΔH=-566 kJ·mol-1。
则CH4与O2反应生成CO和H2的热化学方程式为_________________________________。
(2)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。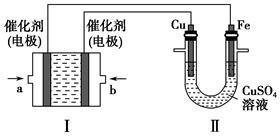
①a处应通入________(填“CH4”或“O2”),b处电极上发生的电极反应式是__________________________________。
②电镀结束后,装置Ⅰ中溶液的pH________(填写“变大”“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度________。
③电镀结束后,装置Ⅰ溶液中的阴离子除了OH-以外还含有________(忽略水解)。
④在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8 g,则装置Ⅰ中理论上消耗甲烷________L(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)在101kPa下,CH4(g)、H2(g)、C(s)的燃烧热分别为890.3kJ?mo1—1、285.8kJ?mo1—1和393.5kJ?mo1—1,则反应C(s)+2H2(g)=CH4(g)的反应热ΔH= 。
(2)已知:2H2(g)+O2(g)=2H2O(g) ΔH1
2H2(g)+O2(g)=2H2O(l) ΔH2
2CO(g)+O2(g)=2CO2(g) ΔH3
①液态水转化为气态水的热化学方程式为 。
②CO和H2分别燃烧生成CO2 (g)和H2O(g),欲得到相同热量,所需CO和H2的体积比是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注。
(1)工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如下: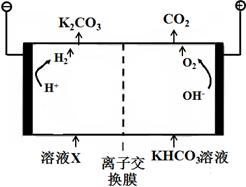
在阳极区发生的反应包括 和H ++ HCO3-=H2O+CO2↑。
简述CO32-在阴极区再生的原理 。
(2)再生装置中产生的CO2和H2在一定条件下反应生成甲醇等产物,工业上利用该反应合成甲醇。
已知:25 ℃,101 KPa下:
H2(g)+1/2 O2(g)=H2O(g) Δ H1=" -242" kJ/mol
CH3OH(g)+3/2 O2(g)=CO2 (g)+2 H2O(g) Δ H2=" -676" kJ/mol
写出CO2和H2生成气态甲醇等产物的热化学方程式 。
下面表示合成甲醇的反应的能量变化示意图,其中正确的是 (填字母序号)。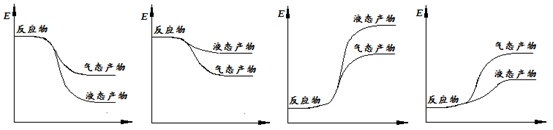
a b c d
(3)微生物燃料电池是一种利用微生物将化学能直接转化成电能的装置。已知某种甲醇
微生物燃料电池中,电解质溶液为酸性,示意图如下: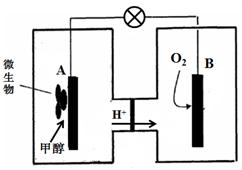
该电池外电路电子的流动方向为 (填写“从A到B”或“从B到A”)。
工作结束后,B电极室溶液的pH与工作前相比将 (填写“增大”、“减小”或“不变”,溶液体积变化忽略不计)。
A电极附近甲醇发生的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
二甲醚(CH3OCH3)是无色气体,可作为一种新型能源,由合成气(组成为H2、CO、和少量CO2)直接制备二甲醚,其中主要过程包括以下四个反应(均为可逆反应):
①CO(g)+ 2H2(g) = CH3OH(g) △H1=—90.1 kJ·mol-1
②CO2(g)+ 3H2(g) = CH3OH(g)+H2O(g) △H2=—49.0 kJ·mol-1
水煤气变换反应③CO(g) + H2O (g)=CO2(g)+H2(g) △H3=—41.1 kJ·mol-1
二甲醚合成反应④2CH3OH(g)=CH3OCH3(g)+H2O(g) △H4=—24.5 kJ·mol-1
(1)由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为 。
(2)一定温度下,在恒容密闭容器中进行反应①,下列描述能说明反应到达平衡状态的是 。
a.容器中气体平均相对分子质量保持不变
b.容器中气体密度保持不变
c.CH3OH(g)浓度保持不变
d.CH3OH(g)的消耗速率等于H2 (g)的消耗速率
(3)一定温度下,将8mol CH3OH(g)充入5L密闭容器中进行反应④,一段时间后到达平衡状态,反应过程中共放出49kJ热量,则CH3OH(g)的平衡转化率为 ,该温度下,平衡常数K= ;该温度下,向容器中再充入2mol CH3OH(g),对再次达到的平衡状态的判断正确的是 。
a.CH3OH(g)的平衡转化率减小
b.CH3OCH3 (g)的体积分数增大
c.H2O(g)浓度为0.5mol·L-1
d.容器中的压强变为原来的1.25倍
(4)二甲醚—氧气燃料电池具有启动快,效率高等优点,其能量密度高于甲醇燃料电池,若电解质为酸性,二甲醚—氧气燃料电池的负极反应为 ;消耗2.8L(标准状况)氧气时,理论上流经外电路的电子 mol
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
100℃时,在1L恒温恒容的密闭容器中,通入0.1 mol N2O4,发生反应:N2O4(g)  2NO2(g);△H=" +57.0" kJ·mol-1,NO2和N2O4的浓度如图甲所示。NO2和N2O4的消耗速率与其浓度的关系如乙图所示,
2NO2(g);△H=" +57.0" kJ·mol-1,NO2和N2O4的浓度如图甲所示。NO2和N2O4的消耗速率与其浓度的关系如乙图所示,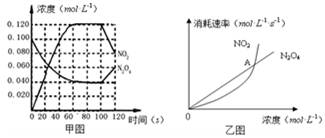
(1)在0~60s内,以N2O4表示的平均反应速率为 mol·L-1·s-1。
(2)根据甲图中有关数据,计算100℃时该反应的平衡常数K1= =0.36mol.L-1.S-1
若其他条件不变,升高温度至120℃,达到新平衡的常数是k2,则k1 k2(填“>”、“<”或“=”)。(3)反应进行到100s时,若有一项条件发生变化,变化的条件可能是 。
A.降低温度 B.通入氦气使其压强增大 C.又往容器中充入N2O4 D.增加容器体积
(4)乙图中, 交点A表示该反应的所处的状态为 。
A.平衡状态 B.朝正反应方向移动 C.朝逆反应方向移动 D.无法判断
(5)已知N2(g)+2O2(g)=2NO2(g) △H=" +67.2" kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=" -534.7" kJ·mol-1
N2O4(g)  2NO2(g) △H=" +57.0" kJ·mol-1
2NO2(g) △H=" +57.0" kJ·mol-1
则2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) △H= kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
臭氧可用于净化空气、饮用水消毒、处理工业废物和作为漂白剂。
(1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:
6Ag(s)+O3(g)= 3Ag2O(s); △H=-236kJ·mol-1,
已知:2Ag2O(s)= 4Ag(s)+O2(g); △H=" +62" kJ·mol-1,
则O3转化为O2的热化学方程式为________________________________________________。
(2)臭氧在水中易分解,臭氧的浓度减少一半所需的时间如下表所示。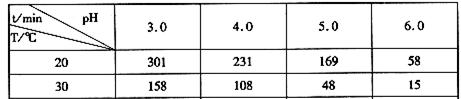
由上表可知pH增大能加速O3分解,表明对O3分解起催化作用的是__________(填微粒符号)。
(3)电解法臭氧发生器具有臭氧浓度高、成分纯净、在水中溶解度高的优势,在医疗、食品加工与养殖业及家庭方面具有广泛应用前景。科学家P.Tatapudi等人首先使用在酸性条件下电解水的方法制得臭氧。
臭氧在阳极周围的水中产生,其电极反应式为_______________________;阴极附近的氧气则生成过氧化氢,其电极反应式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)在298K时,1molCH4在氧气中完全燃烧生成二氧化碳和液态水,放出热量890.0 kJ。写出该反应的热化学方程式 。现有CH4和CO的混合气体0.75mol,完全燃烧后,生成CO2气体和18克液态水,并放出515kJ热量,则CH4和CO的物质的量分别为 、 mol.
(2)利用该反应设计一个燃料电池:用氢氧化钾溶液作电解质溶液,多孔石墨做电极,在电极上分别通入甲烷和氧气。通入甲烷气体的电极应为 极(填写“正”或“负”),该电极上发生的电极反应是 (填字母代号)。
a. CH4—e- + 2O2 ="=" CO2 + 2H2O
b. CH4—8e- + 10OH- ="=" CO32- + 7H2O
c. O2 + 2H2O + 4 e- ="=" 4OH-
d. O2—4 e- + 4H+ ="=" 2H2O
(3)在如图所示实验装置中,石墨棒上的电极反应式为 ;如果起始时盛有1000mL pH=5的硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的pH变为1,此时可观察到的现象是 ;若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入 (填物质名称),其质量约为 。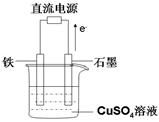
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
把煤作为燃料可通过下列两种途径:
途径I:C(s) +O2 (g) == CO2(g) △H1<0 ①
途径II:先制成水煤气:C(s) +H2O(g) == CO(g)+H2(g) △H2>0 ②
再燃烧水煤气:2CO(g)+O2 (g) == 2CO2(g) △H3<0 ③
2H2(g)+O2 (g) == 2H2O(g) △H4<0 ④
请回答下列问题:
(1) 途径I放出的热量 ( 填“大于”“等于”或“小于”) 途径II放出的热量。
(2) △H1、△H2、△H3、△H4的数学关系式是 。
(3)12g炭粉在氧气中不完全燃烧生成一氧化碳,放出110.35kJ热量。其热化学方程式为 。
(4)煤炭作为燃料采用途径II的优点有
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com