
【题目】当光束通过下列物质时,会出现丁达尔效应的是
A.水B.Fe(OH)3胶体C.蔗糖溶液D.FeCl3溶液
科目:高中化学 来源: 题型:
【题目】已知:RCH2COOH![]() RCHClCOOH、
RCHClCOOH、![]() 。
。
Ⅰ.冠心平F是降血脂、降胆固醇的药物,它的一条合成路线如下:
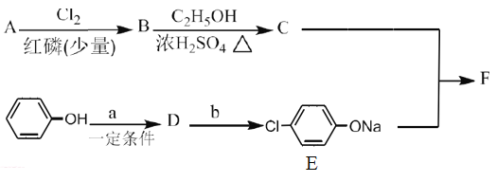
(1)A为一元羧酸,8.8gA与足量NaHCO3溶液反应生成2.24LCO2(标准状况),A的分子式为__________。
(2)写出符合A分子式的所有甲酸酯的结构简式:__________。
(3)B是氯代羧酸,其核磁共振谱有两个峰,写出B→C的反应方程式:__________。
(4)C+E→F的反应类型为__________。
(5)写出A和F的结构简式:A.__________;F.__________。
(6)D的苯环上有两种氢,它所含官能团的名称为__________;写出a、b所代表的试剂:a.__________;b.__________。
Ⅱ.(7)有机物H的分子式为C2H2O3,可发生银镜反应,且具有酸性H有多种合成方法,在方框中写出由乙酸合成H的路线流程图(其他原料任选)。_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A是近年来采用的锅炉水添加剂,其结构式如图,A能除去锅炉水中溶解的氧气,下列说法正确的是( )
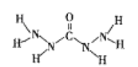
A. A分子中所有原子都在同一平面内
B. A分子中所含的σ键与π键个数之比为10:1
C. 所含C、N均为sp2杂化
D. A与O2反应生成CO2、N2、H2O的物质的量之比为1:2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用60 g乙酸和46 g乙醇反应,如果实际产率是理论产率的一半,则可得到的乙酸乙酯的质量是( )
A. 29.5gB. 44 gC. 74.8 gD. 88 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇脱氢可制取甲醛:CH3OH(g) ![]() HCHO(g)+H2(g)+Q,甲醇的平衡转化率随温度变化曲线如图所示。下列有关说法正确的是( )
HCHO(g)+H2(g)+Q,甲醇的平衡转化率随温度变化曲线如图所示。下列有关说法正确的是( )
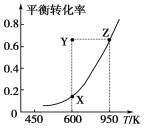
A. Q>0
B. 600 K时,Y点甲醇的v(正)<v(逆)
C. 从Y点到Z点可通过增大压强实现
D. 从Y点到X点可通过使用催化剂实现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镉镍可充电电池在现代生活中有广泛应用,它的充、放电反应按下式进行:Cd+2NiOOH+2H2O![]() Cd(OH)2+2Ni(OH)2 ,由此判断错误的是:( )
Cd(OH)2+2Ni(OH)2 ,由此判断错误的是:( )
A.放电时,Cd作负极
B.放电时,NiO(OH)作负极
C.电解质溶液为碱性溶液
D.放电时,负极反应为Cd+2OH--2e-=Cd(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃下,现有0.1mol·L-1的H2SO4和0.1 mol·L-1一元弱酸HA两种溶液。
(1)则0.1 mol·L-1一元弱酸HA的电离平衡常数表达式Ka=______________。
(2)0.1mol·L-1的H2SO4中水电离出的C(H+)为____________。
(3)向0.1mol·L-1的硫酸中加入一定体积的pH=13的NaOH溶液,反应后溶液的pH为2,则所需NaOH溶液与硫酸的体积比为_________;
(4)向0.1 mol·L-1一元弱酸HA加入一定体积的水,在此过程中,下列数值变大的是__________。
①c(H+) ② 电离度(α) ③c(OH-) ④ Ka ⑤c(A-)/ c(HA) ⑥n(A-)
(5)实验室在配制溶液时,一些物质存在水解的情况,在配制Al2(SO4)3溶液时,Al3+也存在水解,请书写水解离子方程式__________,为了防止Al2(SO4)3发生水解,可加入少量的__________.
(6)已知25 ℃,碳酸的电离平衡常数Ka1= 4.0×10-7,Ka2= 5.6×10-11,则该温度下NaHCO3的水解平衡常数Kh=_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学利用下图装置对电解氯化铜实验进行了研究。
装置 | 现象 |
| 电解一段时间时,阳极石墨表面产生气体,阴极石墨上附着红色物质,溶液由蓝色变为绿色 |
(1)甲认为电解过程中阳极产生的_________是溶液变绿的原因,写出产生该物质的电极反应式:_________________________。
(2)乙改用下图装置,在相同条件下电解CuCl2溶液,对溶液变色现象继续探究。
装置 | 现象 |
| 电解相同时间时,阳极石墨表面产生气泡,溶液仍为蓝色;阴极石墨上附着红色物质,溶液由蓝色变为绿色; |
乙通过对现象分析证实了甲的观点不是溶液变绿的主要原因。乙否定甲的依据是______________。
(3)乙继续查阅资料:
i. 电解CuCl2溶液时可能产生[CuCl2]--,[CuCl2]- 掺杂Cu2+ 后呈黄色
ii. 稀释含[CuCl2]- 的溶液生成CuCl白色沉淀,据此乙认为:电解过程中,产生[CuCl2]_掺杂Cu2+后呈黄色,与CuCl2蓝色溶液混合呈绿色。
乙进行如下实验:
a.取电解后绿色溶液2 mL,加20 mL水稀释,静置5分钟后溶液中产生白色沉淀。
b. 另取少量氯化铜晶体和铜粉,向其中加2 mL浓盐酸,加热获得含[CuCl2]_的黄色溶液。
c. 冷却后向上述溶液……
d. 取c中2 mL溶液,加20 mL水稀释,静置5分钟后溶液中产生白色沉淀。
① a的目的是__________________________________________。
② 写出b中生成[CuCl2]- 的离子方程式:____________________________________________。
③ 补充c中必要的操作及现象:____________________________________________。
乙据此得出结论:电解时阴极附近生成[CuCl2]- 是导致溶液变绿的原因。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com