
【题目】25℃下,现有0.1mol·L-1的H2SO4和0.1 mol·L-1一元弱酸HA两种溶液。
(1)则0.1 mol·L-1一元弱酸HA的电离平衡常数表达式Ka=______________。
(2)0.1mol·L-1的H2SO4中水电离出的C(H+)为____________。
(3)向0.1mol·L-1的硫酸中加入一定体积的pH=13的NaOH溶液,反应后溶液的pH为2,则所需NaOH溶液与硫酸的体积比为_________;
(4)向0.1 mol·L-1一元弱酸HA加入一定体积的水,在此过程中,下列数值变大的是__________。
①c(H+) ② 电离度(α) ③c(OH-) ④ Ka ⑤c(A-)/ c(HA) ⑥n(A-)
(5)实验室在配制溶液时,一些物质存在水解的情况,在配制Al2(SO4)3溶液时,Al3+也存在水解,请书写水解离子方程式__________,为了防止Al2(SO4)3发生水解,可加入少量的__________.
(6)已知25 ℃,碳酸的电离平衡常数Ka1= 4.0×10-7,Ka2= 5.6×10-11,则该温度下NaHCO3的水解平衡常数Kh=_____________。
【答案】 C(A-).C(H+ )/C( HA) 5.0×10-14 19:11 ②③⑤⑥ Al3++3H2O![]() Al(OH)3+3H+ 硫酸 2.5×10-8
Al(OH)3+3H+ 硫酸 2.5×10-8
【解析】
(1)根据一元弱酸HA的电离方程:HA![]() H++A-写出电离平衡常数表达式;(2)水电离的氢离子等于溶液中氢氧根离子浓度;(3)由反应后溶液的pH为2,列出计算式;(4)加水稀释弱酸,促进弱酸电离,但氢离子浓度减小,温度不变水的离子积常数不变,则溶液中氢氧根离子浓度增大,据此分析解答。(5)由水解平衡原理解答;(6)根据Kh=c(H2CO3)c(OH-)/c(HCO3-)求解。
H++A-写出电离平衡常数表达式;(2)水电离的氢离子等于溶液中氢氧根离子浓度;(3)由反应后溶液的pH为2,列出计算式;(4)加水稀释弱酸,促进弱酸电离,但氢离子浓度减小,温度不变水的离子积常数不变,则溶液中氢氧根离子浓度增大,据此分析解答。(5)由水解平衡原理解答;(6)根据Kh=c(H2CO3)c(OH-)/c(HCO3-)求解。
(1)一元弱酸HA的电离方程:HA![]() H++A-,0.1 mol·L-1一元弱酸HA的电离平衡常数表达式Ka= C(A-).C(H+ )/C( HA)。(2)0.1mol·L-1的H2SO4中水电离出的C(H+)=
H++A-,0.1 mol·L-1一元弱酸HA的电离平衡常数表达式Ka= C(A-).C(H+ )/C( HA)。(2)0.1mol·L-1的H2SO4中水电离出的C(H+)=![]() mol·L-1=5.O×10-14mol·L-1。(3)向0.1mol·L-1的硫酸中加入一定体积的pH=13的NaOH溶液,反应后溶液的pH为2,设所需NaOH溶液体积为x与硫酸的体积为y,
mol·L-1=5.O×10-14mol·L-1。(3)向0.1mol·L-1的硫酸中加入一定体积的pH=13的NaOH溶液,反应后溶液的pH为2,设所需NaOH溶液体积为x与硫酸的体积为y,![]() ,x:y=19:11;(4)①加水稀释促进弱酸电离,氢离子的物质的量增大,但溶液体积增大的倍数大于氢离子增大的物质的量,溶液氢离子浓度减小,故错误; ② 加水稀释促进弱酸电离,所以酸分子个数减少,酸根离子个数增大,电离度(α)增大,故正确; ③加水稀释促进弱酸电离,氢离子的物质的量增大,但溶液体积增大的倍数大于氢离子增大的物质的量,溶液氢离子浓度减小,c(OH-)增大,故正确; ④ 温度不变,电离常数不变,故错误; ⑤加水稀释促进弱酸电离,所以酸分子个数减少,酸根离子个数增大,c(A-)/ c(HA)增大,故正确; ⑥加水稀释促进弱酸电离,所以酸分子个数减少,酸根离子个数增大,n(A-)增大,故正确;故选②③⑤⑥;(5)在配制Al2(SO4)3溶液时,Al3+存在水解,水解离子方程式Al3++3H2O
,x:y=19:11;(4)①加水稀释促进弱酸电离,氢离子的物质的量增大,但溶液体积增大的倍数大于氢离子增大的物质的量,溶液氢离子浓度减小,故错误; ② 加水稀释促进弱酸电离,所以酸分子个数减少,酸根离子个数增大,电离度(α)增大,故正确; ③加水稀释促进弱酸电离,氢离子的物质的量增大,但溶液体积增大的倍数大于氢离子增大的物质的量,溶液氢离子浓度减小,c(OH-)增大,故正确; ④ 温度不变,电离常数不变,故错误; ⑤加水稀释促进弱酸电离,所以酸分子个数减少,酸根离子个数增大,c(A-)/ c(HA)增大,故正确; ⑥加水稀释促进弱酸电离,所以酸分子个数减少,酸根离子个数增大,n(A-)增大,故正确;故选②③⑤⑥;(5)在配制Al2(SO4)3溶液时,Al3+存在水解,水解离子方程式Al3++3H2O![]() Al(OH)3+3H+ ,为了防止Al2(SO4)3发生水解,可加入少量的硫酸.(6)该温度下NaHCO3的水解平衡常数HCO3-+H2O
Al(OH)3+3H+ ,为了防止Al2(SO4)3发生水解,可加入少量的硫酸.(6)该温度下NaHCO3的水解平衡常数HCO3-+H2O![]() H2CO3+OH-,Kh=c(H2CO3)c(OH-)/c(HCO3-)=Kw/Ka1=10-14/ 4.0×10-7=2.5×10-8。
H2CO3+OH-,Kh=c(H2CO3)c(OH-)/c(HCO3-)=Kw/Ka1=10-14/ 4.0×10-7=2.5×10-8。


科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.只要是澄清、透明的液体就可直接饮用
B.大地震中的核泄漏事件,引起人类反思,要更安全可靠地利用核能
C.有人认为,为了食品安全,应禁止生产和使用任何包装食品的塑料制品
D.有人认为,食品添加剂对人体都有害,所以要禁止生产和使用任何食品添加剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
|
|
|
|
a极质量减小,b极质量增加 | b极有气体产生,c极无变化 | d极溶解,c极有气体产生 | 电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是
A. d>a>b>cB. b>c>d>aC. a>b>c>dD. a>b>d>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,NOx和SO2是雾霾的主要成分。
Ⅰ. NOx主要来源于汽车尾气,可以利用化学方法将二者转化为无毒无害的物质。
已知:N2(g)+O2(g) ![]() 2NO(g) ΔH=+180 kJ·mol-1
2NO(g) ΔH=+180 kJ·mol-1
2CO(g)+O2(g) ![]() 2CO2(g) ΔH=-564 kJ·mol-1
2CO2(g) ΔH=-564 kJ·mol-1
(1)2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ΔH=________.
2CO2(g)+N2(g) ΔH=________.
(2)T℃时,将等物质的量的NO和CO充入容积为2 L的密闭容器中,保持温度和体积不变,反应过程(0~15 min)中NO的物质的量随时间变化如图所示。
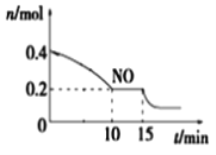
①已知:平衡时气体的分压=气体的体积分数×体系的总压强,T℃时达到平衡,此时体系的总压强为p=20MPa,则T℃时该反应的压力平衡常数Kp =_______;平衡后,若保持温度不变,再向容器中充入NO和CO2各0.3mol,平衡将_____ (填“向左”、“向右”或“不”)移动。
②15 min时,若改变外界反应条件,导致n(NO)发生如上图所示的变化,则改变的条件可能是_____(填序号)
A.增大CO浓度 B.升温 C.减小容器体积 D.加入催化剂
Ⅱ. SO2主要来源于煤的燃烧。燃烧烟气的脱硫减排是减少大气中含硫化合物污染的关键。
已知:亚硫酸:Ka1=2.0×10-2 Ka2=6.0×10-7
(3)请通过计算证明,NaHSO3溶液显酸性的原因:_________________________
(4)如图示的电解装置,可将雾霾中的NO、SO2转化为硫酸铵,从而实现废气的回收再利用。通入NO的电极反应式为____________________;若通入的NO体积为4.48L(标况下),则另外一个电极通入的SO2质量至少为________g。
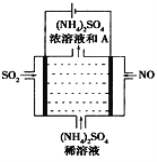
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是理想的烟气脱硝试剂,其脱硝反应为2NO2(g)+O3(g)![]() N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
A | B | C | D |
|
|
|
|
0~3 s内,反应速率v(O3)=0.2 mol·L-1·s-1 | 降低温度,平衡常数增大 | t1时仅加入催化剂,平衡正向移动 | 达平衡时,仅改变x,则x为c(O2) |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于取代反应的是
A. 乙烯在空气中燃烧 B. 在镍做催化剂的条件下,苯与氢气反应
C. 在FeBr3催化作用下,苯与液溴反应 D. 乙醇在铜或银作催化剂条件下与氧气反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】呋喃酚是合成农药的重要中间体,其合成路线如下:
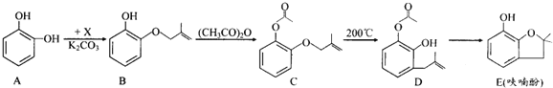
(1)A在空气中久置会由无色转变为棕褐色,其原因是____________,A在核磁共振氢谱中有___________组峰。
(2)B→C的反应类型是_____________________。
(3)已知X的分子式为C4H7Cl。写出A→B的化学方程式:___________________。
(4)要鉴别化合物C和D,适宜的试剂是__________________________。
(5)B的同分异构体很多,符合下列条件的有______种,写出其中能发生银镜反应的同分异构体的结构简式:__________(任写一种)。
①苯的衍生物 ②有两个互为对位的取代基 ③含有酯基
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com