
【题目】研究发现,NOx和SO2是雾霾的主要成分。
Ⅰ. NOx主要来源于汽车尾气,可以利用化学方法将二者转化为无毒无害的物质。
已知:N2(g)+O2(g) ![]() 2NO(g) ΔH=+180 kJ·mol-1
2NO(g) ΔH=+180 kJ·mol-1
2CO(g)+O2(g) ![]() 2CO2(g) ΔH=-564 kJ·mol-1
2CO2(g) ΔH=-564 kJ·mol-1
(1)2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ΔH=________.
2CO2(g)+N2(g) ΔH=________.
(2)T℃时,将等物质的量的NO和CO充入容积为2 L的密闭容器中,保持温度和体积不变,反应过程(0~15 min)中NO的物质的量随时间变化如图所示。
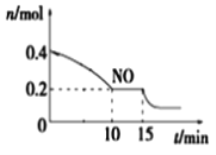
①已知:平衡时气体的分压=气体的体积分数×体系的总压强,T℃时达到平衡,此时体系的总压强为p=20MPa,则T℃时该反应的压力平衡常数Kp =_______;平衡后,若保持温度不变,再向容器中充入NO和CO2各0.3mol,平衡将_____ (填“向左”、“向右”或“不”)移动。
②15 min时,若改变外界反应条件,导致n(NO)发生如上图所示的变化,则改变的条件可能是_____(填序号)
A.增大CO浓度 B.升温 C.减小容器体积 D.加入催化剂
Ⅱ. SO2主要来源于煤的燃烧。燃烧烟气的脱硫减排是减少大气中含硫化合物污染的关键。
已知:亚硫酸:Ka1=2.0×10-2 Ka2=6.0×10-7
(3)请通过计算证明,NaHSO3溶液显酸性的原因:_________________________
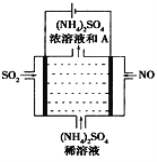
(4)如图示的电解装置,可将雾霾中的NO、SO2转化为硫酸铵,从而实现废气的回收再利用。通入NO的电极反应式为____________________;若通入的NO体积为4.48L(标况下),则另外一个电极通入的SO2质量至少为________g。
【答案】 -744 kJ·mol-1 0.0875 (或7/80) 不 AC HSO3-的水解常数K=Kw/Ka1=5.0×10-13<Ka2=6.0×10-7(HSO3-的电离常数),所以显酸性 6H++ NO+ 5e- = NH![]() +H2O 32
+H2O 32
【解析】
本题考查盖斯定律、化学平衡常数计算、勒夏特列原理、电离平衡常数、水解平衡常数、水的离子积的关系等。
(1)由盖斯定律可知:①N2(g)+O2(g) ![]() 2NO(g),②2CO(g)+O2(g)
2NO(g),②2CO(g)+O2(g) ![]() 2CO2(g),②-①得出:△H=(-564-180)kJ·mol-1=-744kJ·mol-1;
2CO2(g),②-①得出:△H=(-564-180)kJ·mol-1=-744kJ·mol-1;
(2) ①2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)
2CO2(g)+N2(g)
起始/mol: 0.4 0.4 0 0
变化/mol: 0.2 0.2 0.2 0.1
平衡/mol: 0.2 0.2 0.2 0.1,
p(NO)=p(CO)=p(CO2)= 20MPa×![]() =
=![]()
p(N2)= 20MPa×![]() =
=![]()
Kp=![]() =
=![]() =0.0875;根据①的分析,化学平衡常数K=5,再向容器中充入NO和CO2各0.3mol,此时的浓度商为仍为5,因此平衡不移动;②15min时,改变某一因素,NO的物质的量减少,说明平衡向正反应方向移动。增大CO的浓度,平衡向正反应方向移动,NO的物质的量减小,A项正确;正反应是放热反应,升温,平衡向逆反应方向移动,NO的物质的量增大,B项错误;减小容器的体积,相当于增大压强,平衡向正反应方向移动,NO物质的量减小,C项正确;加入催化剂,化学平衡不移动,D项错误;(3)HSO3-的水解常数K=Kw/Ka1=5.0×10-13<Ka2=6.0×10-7,电离平衡常数大于水解
=0.0875;根据①的分析,化学平衡常数K=5,再向容器中充入NO和CO2各0.3mol,此时的浓度商为仍为5,因此平衡不移动;②15min时,改变某一因素,NO的物质的量减少,说明平衡向正反应方向移动。增大CO的浓度,平衡向正反应方向移动,NO的物质的量减小,A项正确;正反应是放热反应,升温,平衡向逆反应方向移动,NO的物质的量增大,B项错误;减小容器的体积,相当于增大压强,平衡向正反应方向移动,NO物质的量减小,C项正确;加入催化剂,化学平衡不移动,D项错误;(3)HSO3-的水解常数K=Kw/Ka1=5.0×10-13<Ka2=6.0×10-7,电离平衡常数大于水解
平衡常数,说明溶液显酸性;(4)根据电解装置,NO和SO2转化为硫酸铵,说明NO转化成NH4+,即NO在阴极上发生NO+6H++5e-=NH4++H2O;阳极反应式为SO2+2H2O-2e-=4H++SO42-,根据得失电子数目守恒,因此有2NO~10e-~5SO2,求出SO2的质量为4.48×5×64/(2×22.4)g=32g。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】甲醇脱氢可制取甲醛:CH3OH(g) ![]() HCHO(g)+H2(g)+Q,甲醇的平衡转化率随温度变化曲线如图所示。下列有关说法正确的是( )
HCHO(g)+H2(g)+Q,甲醇的平衡转化率随温度变化曲线如图所示。下列有关说法正确的是( )
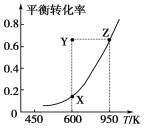
A. Q>0
B. 600 K时,Y点甲醇的v(正)<v(逆)
C. 从Y点到Z点可通过增大压强实现
D. 从Y点到X点可通过使用催化剂实现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔是重要的化工原料,广泛用于有机合成和氧炔焊等。生产乙炔的方法有多种,如电石法、甲烷裂解法等。
(1)在Co(NO3)2催化下,乙炔可被50%的浓硝酸(硝酸被还原为NO2)在20~70℃时直接氧化为H2C2O4·2H2O。
①该反应的化学方程式为____________________________________________________;
②实际生产中硝酸可循环利用而不被消耗,用方程式说明:__________________。
(2)电石法原理为:由石油焦与生石灰在电炉中生成电石CaC2(含Ca3P2、CaS等杂质),电石与水反应生成C2H2(含PH3及H2S等杂质)。
①已知焦炭固体与氧化钙固体每生成l g CaC2固体,同时生成CO气体吸收7.25kJ的热量,则该反应的热化学方程式为______________________________________________;
②用CuSO4溶液净化乙炔气体,去除PH3的反应之一为:
4CuSO4+PH3+4H2O==4Cu↓+H3PO4+4H2SO4,每去除1 mol PH3,该反应中转移电子的物质的量为__________;
③电石法工艺流程简单、容易操作、乙炔纯度高,缺点是___________________(举1例)。
(3)甲烷裂解法原理为:2CH4(g)![]() C2H2(g)+3H2(g) △H,实验测得该反应的Kp(用平衡分压代替浓度计算的平衡常数,分压=总压×物质的量分数)与温度的关系如下图所示:
C2H2(g)+3H2(g) △H,实验测得该反应的Kp(用平衡分压代替浓度计算的平衡常数,分压=总压×物质的量分数)与温度的关系如下图所示:
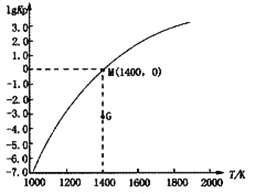
①该反应的△H________0(填“>”、“=”或“<”);
②图中G点v(正)______v(逆)(填“>”、“=”或“<”);
③M点时,若容器中气体的总物质的量为1 mol,CH4、C2H2及H2的物质的量分别为a、b、c,则总压P与a、b、c之间的关系为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃下,现有0.1mol·L-1的H2SO4和0.1 mol·L-1一元弱酸HA两种溶液。
(1)则0.1 mol·L-1一元弱酸HA的电离平衡常数表达式Ka=______________。
(2)0.1mol·L-1的H2SO4中水电离出的C(H+)为____________。
(3)向0.1mol·L-1的硫酸中加入一定体积的pH=13的NaOH溶液,反应后溶液的pH为2,则所需NaOH溶液与硫酸的体积比为_________;
(4)向0.1 mol·L-1一元弱酸HA加入一定体积的水,在此过程中,下列数值变大的是__________。
①c(H+) ② 电离度(α) ③c(OH-) ④ Ka ⑤c(A-)/ c(HA) ⑥n(A-)
(5)实验室在配制溶液时,一些物质存在水解的情况,在配制Al2(SO4)3溶液时,Al3+也存在水解,请书写水解离子方程式__________,为了防止Al2(SO4)3发生水解,可加入少量的__________.
(6)已知25 ℃,碳酸的电离平衡常数Ka1= 4.0×10-7,Ka2= 5.6×10-11,则该温度下NaHCO3的水解平衡常数Kh=_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究人员从木耳菜中提取过氧化物酶(POD),分别与四种不同酚类物质及H2O2进行催化反应,结果如图所示。下列相关说法正确的是
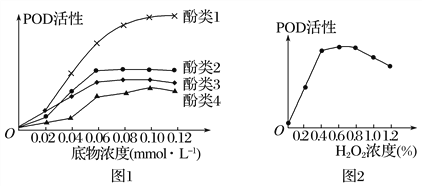
A. 图1所示的实验目的是探究不同酚类物质的浓度对POD活性的影响
B. 当底物浓度为0.08 mmolL-1时,POD催化酚类2的反应速率一定大于酚类3
C. 由图2可知,H2O2浓度过高会抑制POD的活性,降低浓度后POD的活性一定会恢复
D. H2O2对POD活性的影响与温度和pH对POD活性的影响相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,C的平均反应速率是0.1mol/(L·min),且此时A的物质的量浓度为0.25 mol/L。
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,C的平均反应速率是0.1mol/(L·min),且此时A的物质的量浓度为0.25 mol/L。
(1)x的值是__________;
(2)B的平均反应速率__________;
(3)则反应开始前放入容器中A的物质的量_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应由两步反应A→B→C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能)。下列有关叙述正确的是( )
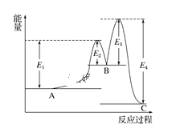
A. 三种化合物中C最稳定B. 加入催化剂会改变反应的焓变
C. 两步反应均为吸热反应D. A→C反应中ΔH=E1 - E2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2![]() 2NO+O2在固定体积的密闭容器中反应,达到平衡状态的标志是 ( )
2NO+O2在固定体积的密闭容器中反应,达到平衡状态的标志是 ( )
(1)单位时间内生成n mol O2的同时生成2n mol NO2
(2)单位时间内生成n mol O2的同时,生成2n mol NO
(3)用NO2 、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:2的状态
(4)混合气体的颜色不再改变的状态
(5)混合气体的平均相对分子质量不再改变的状态
A. 仅(1)(4)(5) B. 仅(2)(3)(5)
C. 仅(1)(3)(4) D. (1)(2)(3)(4)(5)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com