
【题目】将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,C的平均反应速率是0.1mol/(L·min),且此时A的物质的量浓度为0.25 mol/L。
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,C的平均反应速率是0.1mol/(L·min),且此时A的物质的量浓度为0.25 mol/L。
(1)x的值是__________;
(2)B的平均反应速率__________;
(3)则反应开始前放入容器中A的物质的量_____________。
【答案】2 0.05mol/(L·min) 2mol
【解析】
(1)根据D的浓度求出V(D),然后根据物质反应时化学速率比等于计量数的比,可得x值;
(2)根据反应速率之比等于化学计量数之比求出V(B);
(3)根据反应速率计算出△n(A)结合5min时A的浓度就可计算出开始时A的浓度及物质的量。
(1) 5min后,测得D的浓度为0.5mol/L,则V(D)= 0.5mol/L÷5min=0.1mol/(L·min);
由于此时V(C)=0.1mol/(L·min)= V(D)。根据反应速率之比等于化学计量数之比,可知X=2;
(2) 根据反应速率之比等于化学计量数之比,V(B):V(D)=1:2,所以V(B)=![]() V(D)= 0.05mol/(L·min);
V(D)= 0.05mol/(L·min);
(3)根据反应速率之比等于化学计量数之比,V(A):V(B)=3:1,V(B)=0.05mol/(L·min),则V(A)=3V(B)=0.15mol/(L·min),A物质变化的物质的量为△n(A)= 0.15mol/(L·min)×5min×2L=1.5mol,此时反应混合物中A的物质的量浓度为0.25 mol/L,未反应的A的物质的量为0.25mol/L×2L=0.5mol,因此反应开始时A物质的物质的量为n(A)=0.5mol+1.5mol=2mol。


科目:高中化学 来源: 题型:
【题目】物质的结构决定物质的性质。请回答下列涉及物质结构和性质的问题:
(1)氨气极易溶于水的主要原因是_____________________。
(2)某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的外围电子排布式为________________。
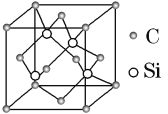
(3)碳化硅的结构与金刚石类似(如图所示),4个硅原子位于体心位置,碳原子位于顶点、面心位置,其硬度仅次于金刚石,具有较强的耐磨性能。碳化硅晶胞结构中每个硅原子周围与其距离最近的碳原子有_______个,碳化硅化学式为________。已知碳化硅晶胞边长为acm,阿伏加德罗常数为NA,则碳化硅的密度为_______g·cm3。
(4)(CH3)3N可用于制备医药、农药,则(CH3)3N_______(填“能”或“不能”)溶于水。化合物(CH3)3N与盐酸反应生成[(CH3)3NH]+,该过程新生成的化学键为_______。
a.离子键 b.配位键 c.氢键 d.非极性共价键
(5)成键原子中的孤电子对对键能有影响,第二周期元素A与氢形成的化合物中A-A键的键能(单位:kJ·mol-1)如下:H3C-CH3 346,H2N-NH2 247,HO-OH 207;
试分析上述化合物中A-A键的键能依次下降的原因__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
|
|
|
|
a极质量减小,b极质量增加 | b极有气体产生,c极无变化 | d极溶解,c极有气体产生 | 电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是
A. d>a>b>cB. b>c>d>aC. a>b>c>dD. a>b>d>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,NOx和SO2是雾霾的主要成分。
Ⅰ. NOx主要来源于汽车尾气,可以利用化学方法将二者转化为无毒无害的物质。
已知:N2(g)+O2(g) ![]() 2NO(g) ΔH=+180 kJ·mol-1
2NO(g) ΔH=+180 kJ·mol-1
2CO(g)+O2(g) ![]() 2CO2(g) ΔH=-564 kJ·mol-1
2CO2(g) ΔH=-564 kJ·mol-1
(1)2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ΔH=________.
2CO2(g)+N2(g) ΔH=________.
(2)T℃时,将等物质的量的NO和CO充入容积为2 L的密闭容器中,保持温度和体积不变,反应过程(0~15 min)中NO的物质的量随时间变化如图所示。
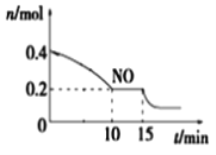
①已知:平衡时气体的分压=气体的体积分数×体系的总压强,T℃时达到平衡,此时体系的总压强为p=20MPa,则T℃时该反应的压力平衡常数Kp =_______;平衡后,若保持温度不变,再向容器中充入NO和CO2各0.3mol,平衡将_____ (填“向左”、“向右”或“不”)移动。
②15 min时,若改变外界反应条件,导致n(NO)发生如上图所示的变化,则改变的条件可能是_____(填序号)
A.增大CO浓度 B.升温 C.减小容器体积 D.加入催化剂
Ⅱ. SO2主要来源于煤的燃烧。燃烧烟气的脱硫减排是减少大气中含硫化合物污染的关键。
已知:亚硫酸:Ka1=2.0×10-2 Ka2=6.0×10-7
(3)请通过计算证明,NaHSO3溶液显酸性的原因:_________________________
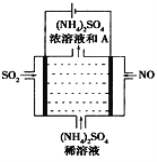
(4)如图示的电解装置,可将雾霾中的NO、SO2转化为硫酸铵,从而实现废气的回收再利用。通入NO的电极反应式为____________________;若通入的NO体积为4.48L(标况下),则另外一个电极通入的SO2质量至少为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是理想的烟气脱硝试剂,其脱硝反应为2NO2(g)+O3(g)![]() N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
A | B | C | D |
|
|
|
|
0~3 s内,反应速率v(O3)=0.2 mol·L-1·s-1 | 降低温度,平衡常数增大 | t1时仅加入催化剂,平衡正向移动 | 达平衡时,仅改变x,则x为c(O2) |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值,下列叙述错误的是
①18 g金刚石中,碳碳共价键数为3NA
②1mol铜与足量硫蒸气反应,转移电子数为 NA
③常温常压时S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA
④一定温度下,1 L 0.50 mol·L━1NH4Cl溶液与2 L 0.25mol·L━1NH4Cl溶液中NH4+的物质的量均小于0.5NA,且前者更少
⑤电解法精炼铜时,当阳极质量减少64g时,电路中通过的电子数一定为2NA
A. ② B. ②④⑤ C. ④⑤ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于取代反应的是
A. 乙烯在空气中燃烧 B. 在镍做催化剂的条件下,苯与氢气反应
C. 在FeBr3催化作用下,苯与液溴反应 D. 乙醇在铜或银作催化剂条件下与氧气反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)有机物命名:
![]() ________________________________;
________________________________;
![]() ___________________________________;
___________________________________;
(2)依据名称写出物质:
3,4-二甲基-4-乙基庚烷 ______________;3,4,4-三甲基-1-戊炔 ______________。
(3)已知有机物降冰片二烯的分子结构可表示为: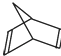
①降冰片二烯的分子式为 ______________;②降冰片二烯属于 __________;
a.环烃 b.不饱和烃 c.烷烃 d.烯烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如图-1和图-2所示。
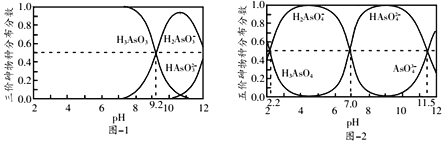
下列说法错误的是( )
A. H3AsO3和Na2HAsO4水溶液可以发生复分解反应
B. H3AsO4水溶液中存在:![]()
C. 向 H3AsO4的溶液中加入一定量的NaOH溶液至pH=5时,![]()
D. 室温下向含0.2mol H3AsO4的溶液中加入12gNaOH固体,所得溶液的pH=7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com