
【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
|
|
|
|
a极质量减小,b极质量增加 | b极有气体产生,c极无变化 | d极溶解,c极有气体产生 | 电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是
A. d>a>b>cB. b>c>d>aC. a>b>c>dD. a>b>d>c
科目:高中化学 来源: 题型:
【题目】甲醇脱氢可制取甲醛:CH3OH(g) ![]() HCHO(g)+H2(g)+Q,甲醇的平衡转化率随温度变化曲线如图所示。下列有关说法正确的是( )
HCHO(g)+H2(g)+Q,甲醇的平衡转化率随温度变化曲线如图所示。下列有关说法正确的是( )
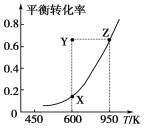
A. Q>0
B. 600 K时,Y点甲醇的v(正)<v(逆)
C. 从Y点到Z点可通过增大压强实现
D. 从Y点到X点可通过使用催化剂实现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镉镍可充电电池在现代生活中有广泛应用,它的充、放电反应按下式进行:Cd+2NiOOH+2H2O![]() Cd(OH)2+2Ni(OH)2 ,由此判断错误的是:( )
Cd(OH)2+2Ni(OH)2 ,由此判断错误的是:( )
A.放电时,Cd作负极
B.放电时,NiO(OH)作负极
C.电解质溶液为碱性溶液
D.放电时,负极反应为Cd+2OH--2e-=Cd(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔是重要的化工原料,广泛用于有机合成和氧炔焊等。生产乙炔的方法有多种,如电石法、甲烷裂解法等。
(1)在Co(NO3)2催化下,乙炔可被50%的浓硝酸(硝酸被还原为NO2)在20~70℃时直接氧化为H2C2O4·2H2O。
①该反应的化学方程式为____________________________________________________;
②实际生产中硝酸可循环利用而不被消耗,用方程式说明:__________________。
(2)电石法原理为:由石油焦与生石灰在电炉中生成电石CaC2(含Ca3P2、CaS等杂质),电石与水反应生成C2H2(含PH3及H2S等杂质)。
①已知焦炭固体与氧化钙固体每生成l g CaC2固体,同时生成CO气体吸收7.25kJ的热量,则该反应的热化学方程式为______________________________________________;
②用CuSO4溶液净化乙炔气体,去除PH3的反应之一为:
4CuSO4+PH3+4H2O==4Cu↓+H3PO4+4H2SO4,每去除1 mol PH3,该反应中转移电子的物质的量为__________;
③电石法工艺流程简单、容易操作、乙炔纯度高,缺点是___________________(举1例)。
(3)甲烷裂解法原理为:2CH4(g)![]() C2H2(g)+3H2(g) △H,实验测得该反应的Kp(用平衡分压代替浓度计算的平衡常数,分压=总压×物质的量分数)与温度的关系如下图所示:
C2H2(g)+3H2(g) △H,实验测得该反应的Kp(用平衡分压代替浓度计算的平衡常数,分压=总压×物质的量分数)与温度的关系如下图所示:
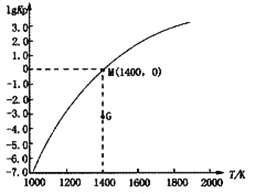
①该反应的△H________0(填“>”、“=”或“<”);
②图中G点v(正)______v(逆)(填“>”、“=”或“<”);
③M点时,若容器中气体的总物质的量为1 mol,CH4、C2H2及H2的物质的量分别为a、b、c,则总压P与a、b、c之间的关系为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃下,现有0.1mol·L-1的H2SO4和0.1 mol·L-1一元弱酸HA两种溶液。
(1)则0.1 mol·L-1一元弱酸HA的电离平衡常数表达式Ka=______________。
(2)0.1mol·L-1的H2SO4中水电离出的C(H+)为____________。
(3)向0.1mol·L-1的硫酸中加入一定体积的pH=13的NaOH溶液,反应后溶液的pH为2,则所需NaOH溶液与硫酸的体积比为_________;
(4)向0.1 mol·L-1一元弱酸HA加入一定体积的水,在此过程中,下列数值变大的是__________。
①c(H+) ② 电离度(α) ③c(OH-) ④ Ka ⑤c(A-)/ c(HA) ⑥n(A-)
(5)实验室在配制溶液时,一些物质存在水解的情况,在配制Al2(SO4)3溶液时,Al3+也存在水解,请书写水解离子方程式__________,为了防止Al2(SO4)3发生水解,可加入少量的__________.
(6)已知25 ℃,碳酸的电离平衡常数Ka1= 4.0×10-7,Ka2= 5.6×10-11,则该温度下NaHCO3的水解平衡常数Kh=_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,C的平均反应速率是0.1mol/(L·min),且此时A的物质的量浓度为0.25 mol/L。
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,C的平均反应速率是0.1mol/(L·min),且此时A的物质的量浓度为0.25 mol/L。
(1)x的值是__________;
(2)B的平均反应速率__________;
(3)则反应开始前放入容器中A的物质的量_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C,D是四种短周期元素,E是过渡元素。A,B,C同周期,C,D同主族,A的原子结构示意图为 ,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2。试回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2。试回答下列问题:
(1)写出下列元素的符号:A__________,B__________,C__________,D__________。
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是________,碱性最强的是__________。
(3)用元素符号表示D所在周期第一电离能最大的元素是________,电负性最大的元素是__________。
(4)E元素原子的核电荷数是__________,E元素在周期表的第________周期第________族,已知元素周期表可按电子排布分为s区、p区等,则E元素在________区。
(5)写出D元素原子构成单质的电子式__________,该分子中有____个σ键,____个π键。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com