
【题目】下列物质可用作食品添加剂的是( )
A.CH3OHB.SO2C.HCHOD.I2
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】根据生活经验,下列物质按pH由小到大的顺序排列正确的是 ( )
① 洁厕灵(主要成分为HCl) ② 厨房去油污清洁剂 ③ 食醋 ④ 肥皂 ⑤ 食盐
A.①②⑤③④B.④③⑤②①C.③①②⑤④D.①③⑤④②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题。
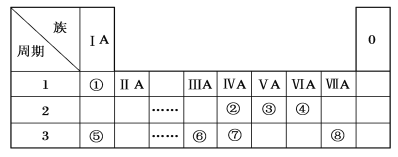
(1)③、④、⑤、⑥的离子半径由大到小的顺序是________。(用离子符号表示)
(2)①、③、④、⑥元素可形成多种含10个电子的微粒,其中A和B为分子,C和E为阳离子,D为阴离子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀。请写出B、D微粒的电子式:B_______,D________。
并写出A、B、E三种微粒反应的离子方程式____________________________。
(3)由④⑤⑧三种元素组成的某种盐是家用消毒液的主要成分,将该盐溶液滴入KI淀粉溶液中溶液变为蓝色,则反应的离子方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关系如图所
示:
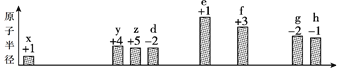
原子序数
下列说法不正确的是( )
A. x、z、d三种元素能形成具有强氧化性的酸
B. 根据g、h的单质与Fe反应的情况,可以判断h的非金属性大于g
C. 工业上通过电解f、h形成的化合物制取f 单质
D. x与其他元素可形成共价化合物或离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.只要是澄清、透明的液体就可直接饮用
B.大地震中的核泄漏事件,引起人类反思,要更安全可靠地利用核能
C.有人认为,为了食品安全,应禁止生产和使用任何包装食品的塑料制品
D.有人认为,食品添加剂对人体都有害,所以要禁止生产和使用任何食品添加剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组以废铁屑制得硫酸亚铁铵后,按下列流程制备二水合草酸亚铁(FeC2O4·2H2O),进一步制备高纯度还原铁粉。

已知:FeC2O4·2H2O难溶于水,150℃开始失结晶水;H2C2O4易溶于水,溶解度随温度升高而增大。
请回答:
(1)下列操作或描述正确的是__________。
A.步骤②,H2C2O4稍过量主要是为了抑制Fe2+水解
B.步骤③,采用热水洗涤可提高除杂效果
C.步骤③,母液中的溶质主要是(NH4)2SO4 和H2C2O4
D.步骤③,如果在常压下快速干燥,温度可选择略高于100℃
(2)如图装置,经过一系列操作完成步骤③中的抽滤和洗涤。请选择合适的编号,按正确的操作顺序补充完整(洗涤操作只需考虑一次):
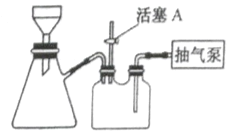
开抽气泵→a→b→d→_________→c→关抽气泵
a.转移固液混合物; b.关活塞A; c.开活塞A; d.确认抽干; e.加洗涤剂洗涤。
(3)称取一定量的FeC2O4·2H2O试样,用硫酸溶解,采用KMnO4滴定法测定,折算结果如下:
n (Fe2+)/mol | n (C2O42-)/mol | 试样中FeC2O4·2H2O的质量分数 |
9.80×10-4 | 9.80×10-4 | 0.980 |
由表中数据推测试样中最主要的杂质是___________
(4)实现步骤④必须用到的两种仪器是_________(供选仪器:a.烧杯;b.坩埚;c.蒸馏烧瓶;d.高温炉;e.表面皿;f.锥形瓶);该步骤的化学方程式是______________________。
(5)为实现步骤⑤,不宜用碳粉还原Fe2O3,理由是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的结构决定物质的性质。请回答下列涉及物质结构和性质的问题:
(1)氨气极易溶于水的主要原因是_____________________。
(2)某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的外围电子排布式为________________。
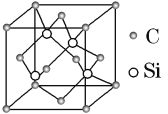
(3)碳化硅的结构与金刚石类似(如图所示),4个硅原子位于体心位置,碳原子位于顶点、面心位置,其硬度仅次于金刚石,具有较强的耐磨性能。碳化硅晶胞结构中每个硅原子周围与其距离最近的碳原子有_______个,碳化硅化学式为________。已知碳化硅晶胞边长为acm,阿伏加德罗常数为NA,则碳化硅的密度为_______g·cm3。
(4)(CH3)3N可用于制备医药、农药,则(CH3)3N_______(填“能”或“不能”)溶于水。化合物(CH3)3N与盐酸反应生成[(CH3)3NH]+,该过程新生成的化学键为_______。
a.离子键 b.配位键 c.氢键 d.非极性共价键
(5)成键原子中的孤电子对对键能有影响,第二周期元素A与氢形成的化合物中A-A键的键能(单位:kJ·mol-1)如下:H3C-CH3 346,H2N-NH2 247,HO-OH 207;
试分析上述化合物中A-A键的键能依次下降的原因__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制1mol/LNaCl溶液250mL,在下列仪器中要用到的是( )
①托盘天平 ②量筒 ③容量瓶 ④滤纸 ⑤烧杯⑥玻璃棒 ⑦酒精灯 ⑧试管 ⑨胶头滴管
A.①③⑤⑥⑦B.①②③④⑤
C.①③⑤⑥⑨D.①②③⑤⑥⑧⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,NOx和SO2是雾霾的主要成分。
Ⅰ. NOx主要来源于汽车尾气,可以利用化学方法将二者转化为无毒无害的物质。
已知:N2(g)+O2(g) ![]() 2NO(g) ΔH=+180 kJ·mol-1
2NO(g) ΔH=+180 kJ·mol-1
2CO(g)+O2(g) ![]() 2CO2(g) ΔH=-564 kJ·mol-1
2CO2(g) ΔH=-564 kJ·mol-1
(1)2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ΔH=________.
2CO2(g)+N2(g) ΔH=________.
(2)T℃时,将等物质的量的NO和CO充入容积为2 L的密闭容器中,保持温度和体积不变,反应过程(0~15 min)中NO的物质的量随时间变化如图所示。
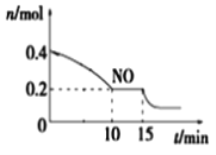
①已知:平衡时气体的分压=气体的体积分数×体系的总压强,T℃时达到平衡,此时体系的总压强为p=20MPa,则T℃时该反应的压力平衡常数Kp =_______;平衡后,若保持温度不变,再向容器中充入NO和CO2各0.3mol,平衡将_____ (填“向左”、“向右”或“不”)移动。
②15 min时,若改变外界反应条件,导致n(NO)发生如上图所示的变化,则改变的条件可能是_____(填序号)
A.增大CO浓度 B.升温 C.减小容器体积 D.加入催化剂
Ⅱ. SO2主要来源于煤的燃烧。燃烧烟气的脱硫减排是减少大气中含硫化合物污染的关键。
已知:亚硫酸:Ka1=2.0×10-2 Ka2=6.0×10-7
(3)请通过计算证明,NaHSO3溶液显酸性的原因:_________________________
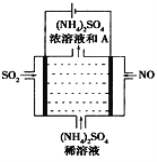
(4)如图示的电解装置,可将雾霾中的NO、SO2转化为硫酸铵,从而实现废气的回收再利用。通入NO的电极反应式为____________________;若通入的NO体积为4.48L(标况下),则另外一个电极通入的SO2质量至少为________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com