
【题目】部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关系如图所
示:
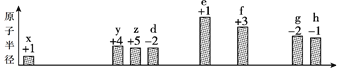
原子序数
下列说法不正确的是( )
A. x、z、d三种元素能形成具有强氧化性的酸
B. 根据g、h的单质与Fe反应的情况,可以判断h的非金属性大于g
C. 工业上通过电解f、h形成的化合物制取f 单质
D. x与其他元素可形成共价化合物或离子化合物
【答案】C
【解析】
利用主族元素的最外层电子数等于所在族序数,以及主要化合价,推出x为H,y为C,z为N,d为O,e为Na,f为Al,g为S,h为Cl,然后进行分析;
利用主族元素的最外层电子数等于所在族序数,以及主要化合价,推出x为H,y为C,z为N,d为O,e为Na,f为Al,g为S,h为Cl,
A、H、N、O可以构成HNO3,HNO3具有强氧化性,也可以构成HNO2,HNO2具有还原性和氧化性,氧化性比还原性突出的多,故A说法正确;
B、Fe与S反应生成FeS,Fe与Cl2反应生成FeCl3,根据形成铁化合物中的铁的化合价,得出Cl的非金属性强于S,故B说法正确;
C、形成的化合物是AlCl3,AlCl3属于共价化合物,熔融状态下不导电,故C说法错误;
D、H与非金属元素,形成共价化合物,H与Na反应生成NaH,NaH为离子化合物,故D说法正确。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。下列说法正确的是( )
A. 18 g H2O、D2O组成的物质中含有的质子数为10NA
B. 1 mol白磷分子(P4)中含有的P—P键的数目为6NA
C. 0.1molNaCl中含有0.1NA个NaCl分子
D. 在反应2Na2O2+CO2===2Na2CO3+O2↑中,每生成32g O2转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】道路千万条,安全第一条,行车不规范,亲人两行泪。减少交通事故除遵守交通法规正确驾驶外,安全措施也极为重要。汽车的安全气嚢内一般充入的是叠氮化钠(NaN3)、硝酸铵(NH4NO3)、硝酸钾(KNO3)等物质。当汽车在高速行驶中受到猛烈撞击时,这些物质会迅速发生分解或发生反应,产生大量气体,充满气囊,从而保护驾驶员和乘客的安全。
请回答下列问题:
(1)下列判断正确的是_______。
A.道路起雾与H2O分子的化学键断裂有关
B.NH4NO3、KNO3中含有化学键的类型完全相同
C.NaN3不会和酸性高锰酸钾或次氯酸钠溶液反应
D.NaN3、NH4NO3固体在储存和使用时都必须格外小心,以免发生爆炸
(2)汽车的安全气囊内叠氮化钠爆炸过程中的能量变化如图所示:
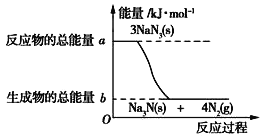
①叠氮化钠的爆炸反应属于_______(填“吸热”或“放热”)反应。
②若爆炸过程中有30mol 非极性键生成(一个共用电子对为一个化学健),则反应的能量变化为____kJ(用含a、b的代数式表示),消耗叠氮化钠的质量为_________g。
(3)若安全气囊内充的是叠氮酸钠和硝酸钾,撞击时发生的反应是10NaN3+2KNO3=K2O+5Na2O+16N2↑。当该反应的氧化产物比还原产物多1.4mol,则转移电子的物质的量是________mol,同时气囊内还必须充入一定量的SiO2粉末,其在安全气囊内所起的作用可能是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~I分别表示中学化学中常见的一种物质,其中A、I为常见金属,它们之间的相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。请填写下列空白:

(1)A、B、C、D、E、F六种物质中所含同一种元素在周期表中的位置是________。
(2)写出C物质的化学式:________。
(3)写出①、⑥反应的化学方程式:
①:____________________________。
⑥:____________________________。
(4)从能量变化的角度看,反应①②③中,属于放热反应的是________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用含结晶水的正盐X(四种短周期元素组成的纯净物)进行了如下实验:
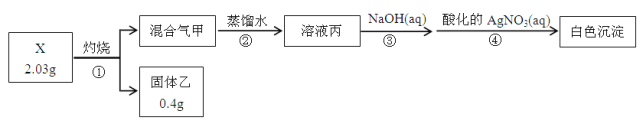
实验中观测到:混合气甲呈无色并被蒸馏水全部吸收;固体乙为纯净物;在步骤③中,取1/10溶液丙,恰好中和需消耗0.00200molNaOH;另取一定量的溶液丙,加入少量K2FeO4固体,产生黄绿色气体。
请回答:
(1)X的化学式是__________,步骤①的化学方程式是______________________________。
(2)溶液丙与K2FeO4固体反应的化学方程式是_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁触媒是重要的催化剂,CO易与铁触媒作用导致其失去催化活性:Fe+5CO=Fe(CO)5;除去CO的化学反应为:[Cu(NH3)2]OOCCH3+CO+NH3=[Cu(NH3)3(CO)]OOCCH3。
(1)基态Fe原子的外围电子排布式:________,C、N、O的第一电离能由大到小的顺序为________。
(2)Fe(CO)5又名羰基铁,常温下为黄色油状液体,则Fe(CO)5的晶体类型是_______,与CO互为等电子体的分子的电子式为______________。
(3)硝酸钾中NO3-的空间构型_______,分子中的大π键可用符号![]() 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为![]() ),则NO3-中的大π键应表示为____________。
),则NO3-中的大π键应表示为____________。
(4)配合物[Cu(NH3)2]OOCCH3中碳原子的杂化类型是________,配位体中提供孤对电子的原子是_____。
(5)用[Cu(NH3)2]OOCCH3除去CO的反应中,肯定有______形成.
a.离子键 b.配位键 c.非极性键 d.σ键
(6)铁和氨气在640 ℃可发生置换反应,产物之一的晶胞结构如图所示,写出该反应的化学方程式__________________ 。
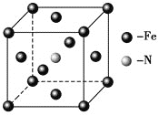
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔是重要的化工原料,广泛用于有机合成和氧炔焊等。生产乙炔的方法有多种,如电石法、甲烷裂解法等。
(1)在Co(NO3)2催化下,乙炔可被50%的浓硝酸(硝酸被还原为NO2)在20~70℃时直接氧化为H2C2O4·2H2O。
①该反应的化学方程式为____________________________________________________;
②实际生产中硝酸可循环利用而不被消耗,用方程式说明:__________________。
(2)电石法原理为:由石油焦与生石灰在电炉中生成电石CaC2(含Ca3P2、CaS等杂质),电石与水反应生成C2H2(含PH3及H2S等杂质)。
①已知焦炭固体与氧化钙固体每生成l g CaC2固体,同时生成CO气体吸收7.25kJ的热量,则该反应的热化学方程式为______________________________________________;
②用CuSO4溶液净化乙炔气体,去除PH3的反应之一为:
4CuSO4+PH3+4H2O==4Cu↓+H3PO4+4H2SO4,每去除1 mol PH3,该反应中转移电子的物质的量为__________;
③电石法工艺流程简单、容易操作、乙炔纯度高,缺点是___________________(举1例)。
(3)甲烷裂解法原理为:2CH4(g)![]() C2H2(g)+3H2(g) △H,实验测得该反应的Kp(用平衡分压代替浓度计算的平衡常数,分压=总压×物质的量分数)与温度的关系如下图所示:
C2H2(g)+3H2(g) △H,实验测得该反应的Kp(用平衡分压代替浓度计算的平衡常数,分压=总压×物质的量分数)与温度的关系如下图所示:
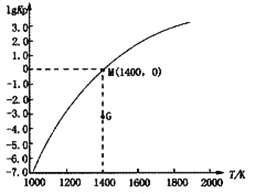
①该反应的△H________0(填“>”、“=”或“<”);
②图中G点v(正)______v(逆)(填“>”、“=”或“<”);
③M点时,若容器中气体的总物质的量为1 mol,CH4、C2H2及H2的物质的量分别为a、b、c,则总压P与a、b、c之间的关系为___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com