
【题目】道路千万条,安全第一条,行车不规范,亲人两行泪。减少交通事故除遵守交通法规正确驾驶外,安全措施也极为重要。汽车的安全气嚢内一般充入的是叠氮化钠(NaN3)、硝酸铵(NH4NO3)、硝酸钾(KNO3)等物质。当汽车在高速行驶中受到猛烈撞击时,这些物质会迅速发生分解或发生反应,产生大量气体,充满气囊,从而保护驾驶员和乘客的安全。
请回答下列问题:
(1)下列判断正确的是_______。
A.道路起雾与H2O分子的化学键断裂有关
B.NH4NO3、KNO3中含有化学键的类型完全相同
C.NaN3不会和酸性高锰酸钾或次氯酸钠溶液反应
D.NaN3、NH4NO3固体在储存和使用时都必须格外小心,以免发生爆炸
(2)汽车的安全气囊内叠氮化钠爆炸过程中的能量变化如图所示:
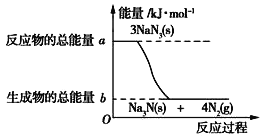
①叠氮化钠的爆炸反应属于_______(填“吸热”或“放热”)反应。
②若爆炸过程中有30mol 非极性键生成(一个共用电子对为一个化学健),则反应的能量变化为____kJ(用含a、b的代数式表示),消耗叠氮化钠的质量为_________g。
(3)若安全气囊内充的是叠氮酸钠和硝酸钾,撞击时发生的反应是10NaN3+2KNO3=K2O+5Na2O+16N2↑。当该反应的氧化产物比还原产物多1.4mol,则转移电子的物质的量是________mol,同时气囊内还必须充入一定量的SiO2粉末,其在安全气囊内所起的作用可能是___________________。
【答案】B、D 放热反应 2.5(a-b)或2.5(b-a) 487.5 1 SiO2与产物K2O、Na2O反应生成无腐蚀性的硅酸盐,减少对人体的伤害
【解析】
(1)A.道路起雾,水分子不变;
B.分析化合物化学键类型;
C.NaN3中N为-1/3价,具有还原性;
D.NaN3受到猛烈撞击时,就会发生化学变化;
(2)①由图可知,反应物的总能量大于生成物的总能量;
②发生3NaN3═Na3N+4N2↑,氮气中N≡N非极性键,由反应及图可知生成12 mol非极性键放热为(a-b)kJ,据此计算;
(3)10NaN3+2KNO3→K2O+5Na2O+16N2↑中,N元素由+5价降低为0,反应中共转移10电子,若氧化产物比还原产物多1.4mol,由反应可知,生成16molN2时氧化产物比还原产物多14mol,据此计算;SiO2是酸性氧化物,可与产物K2O、Na2O反应。
(1)A. 道路起雾,水分子不变,水分子中化学键不变,A项错误;
B.NH4NO3含离子键、共价键,N、O之间为极性共价键,KNO3由钾离子与硝酸根离子构成,硝酸根离子中N与O原子之间为极性共价键,则两者化学键类型相同,B项正确;
C. NaN3具有还原性,可和酸性高锰酸钾或次氯酸钠溶液反应,C项错误;
D. NaN3受到猛烈撞击时,就会发生化学变化; NH4NO3固体属于易燃易爆固体,在储存和使用时都必须格外小心,以免发生爆炸,D项正确;
故答案为:B、D;
(2)①由图可知,反应物的总能量大于生成物的总能量,为放热反应;
②发生3NaN3═Na3N+4N2↑,氮气中N≡N非极性键,由反应及图可知生成12 mol非极性键放热为(ab) kJ,则有30 mol非极性键生成(一个共用电子对为一个化学健),则反应的能量变化为(ab) kJ×![]() = 2.5(a-b)或(ba) kJ×
= 2.5(a-b)或(ba) kJ×![]() =2.5(b-a),消耗叠氮化钠的质量为
=2.5(b-a),消耗叠氮化钠的质量为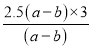 mol×65g/mol = 487.5 g,
mol×65g/mol = 487.5 g,
故答案为:2.5(a-b)或2.5(b-a);487.5;
(3)10NaN3+2KNO3→K2O+5Na2O+16N2↑中,N元素由+5价降低为0,反应中共转移10电子,若氧化产物比还原产物多1.4mol,由反应可知,生成16mol N2时氧化产物比还原产物多14mol,则该反应生成氮气为![]() = 1.6mol,根据关系式16N2
= 1.6mol,根据关系式16N2![]() 10e-可知转移电子的物质的量是
10e-可知转移电子的物质的量是![]() ×1.6 mol=1mol; 同时气囊内还必须充入一定量的SiO2粉末,其在安全气囊内所起的作用可能是SiO2与产物K2O、Na2O反应生成无腐蚀性的硅酸盐,减少对人体的伤害,故答案为:1mol;SiO2与产物K2O、Na2O反应生成无腐蚀性的硅酸盐,减少对人体的伤害。
×1.6 mol=1mol; 同时气囊内还必须充入一定量的SiO2粉末,其在安全气囊内所起的作用可能是SiO2与产物K2O、Na2O反应生成无腐蚀性的硅酸盐,减少对人体的伤害,故答案为:1mol;SiO2与产物K2O、Na2O反应生成无腐蚀性的硅酸盐,减少对人体的伤害。


科目:高中化学 来源: 题型:
【题目】根据生活经验,下列物质按pH由小到大的顺序排列正确的是 ( )
① 洁厕灵(主要成分为HCl) ② 厨房去油污清洁剂 ③ 食醋 ④ 肥皂 ⑤ 食盐
A.①②⑤③④B.④③⑤②①C.③①②⑤④D.①③⑤④②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl﹣KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为PbSO4+2LiCl+Ca═ CaCl2+Li2SO4+Pb。下列有关说法正确的是

A. 正极反应式:Ca+2Cl-﹣2e-= CaCl2
B. 放电过程中,Li+向负极移动
C. 常温时,在正负极间接上电流表或检流计,指针发生偏转
D. 每转移0.1 mol电子,理论上生成10.35g Pb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g)中,4 mol HCl被氧化,放出115.6 kJ的热量。又知:
2Cl2(g)+2H2O(g)中,4 mol HCl被氧化,放出115.6 kJ的热量。又知:![]() ,判断下列说法正确的是( )
,判断下列说法正确的是( )
A. 该反应的ΔH=+115.6 kJ·mol-1
B. 断开1 mol H—O 键与断开1 mol H—Cl 键所需能量相差约为32 kJ
C. H2O中H—O 键比HCl中H—Cl键弱
D. 由所提供数据判断氯元素的非金属性比氧元素强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题。
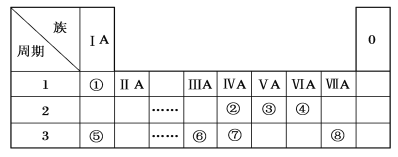
(1)③、④、⑤、⑥的离子半径由大到小的顺序是________。(用离子符号表示)
(2)①、③、④、⑥元素可形成多种含10个电子的微粒,其中A和B为分子,C和E为阳离子,D为阴离子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀。请写出B、D微粒的电子式:B_______,D________。
并写出A、B、E三种微粒反应的离子方程式____________________________。
(3)由④⑤⑧三种元素组成的某种盐是家用消毒液的主要成分,将该盐溶液滴入KI淀粉溶液中溶液变为蓝色,则反应的离子方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关系如图所
示:
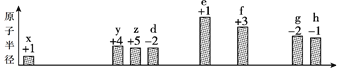
原子序数
下列说法不正确的是( )
A. x、z、d三种元素能形成具有强氧化性的酸
B. 根据g、h的单质与Fe反应的情况,可以判断h的非金属性大于g
C. 工业上通过电解f、h形成的化合物制取f 单质
D. x与其他元素可形成共价化合物或离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制1mol/LNaCl溶液250mL,在下列仪器中要用到的是( )
①托盘天平 ②量筒 ③容量瓶 ④滤纸 ⑤烧杯⑥玻璃棒 ⑦酒精灯 ⑧试管 ⑨胶头滴管
A.①③⑤⑥⑦B.①②③④⑤
C.①③⑤⑥⑨D.①②③⑤⑥⑧⑨
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com