
【题目】热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl﹣KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为PbSO4+2LiCl+Ca═ CaCl2+Li2SO4+Pb。下列有关说法正确的是

A. 正极反应式:Ca+2Cl-﹣2e-= CaCl2
B. 放电过程中,Li+向负极移动
C. 常温时,在正负极间接上电流表或检流计,指针发生偏转
D. 每转移0.1 mol电子,理论上生成10.35g Pb
科目:高中化学 来源: 题型:
【题目】将4.34 g Na、Na2O、Na2O2的混合物与足量的水反应,在标准状况下得到672 mL混合气体,将混合气体通电后恰好完全反应,则Na、Na2O、Na2O2的物质的量之比为
A. 4∶3∶2 B. 1∶2∶1 C. 1∶1∶2 D. 1∶1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用铝土矿(主要成分为Al2O3,SiO2和Fe2O3等杂质)为原料制备铝氢化钠,铝氢化钠(NaAlH4)是有机合成的重要还原剂,工艺流程如下:
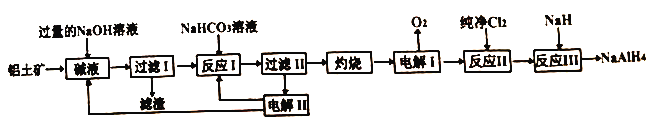 已知:SiO2在“碱液”中转化为铝硅酸钠Na2Al2SixO8)沉淀。
已知:SiO2在“碱液”中转化为铝硅酸钠Na2Al2SixO8)沉淀。
(1)过量NaOH溶液溶解铝土矿时为了提高浸出率可采取的措施是_______。(任写一种)
(2)电解I的化学方程式_______。
(3)“灼烧”操作用到的主要仪器有_______、_______、三脚架、玻璃棒、酒精灯、坩埚钳。
(4)“电解II”是电解Na2CO3溶液,原理如图所示。
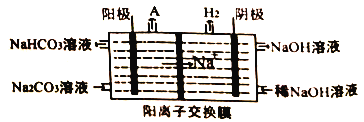
物质A为_______。(填化学式)
(5)反应III的化学方程式为_______,某同学经过分析认为可以再设计一个电解槽,电解_______ (填物质名称)溶液,更能实现副产物的循环利用。
(6)某同学认为该制备工艺也可以先酸溶,再加入NaOH溶液,当溶液中铁离子沉淀完全时,此时溶液pH是_______。(一般认为室温下离子浓度小于10-5mol/L时沉淀完全;Ksp[Fe(OH)3]=1×10-35,Ksp[Al(OH)3]=3×10-34)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物![]() (x)、
(x)、 (y)、
(y)、![]() (z)的分子式均为C8H8,下列说法正确的是
(z)的分子式均为C8H8,下列说法正确的是
A. y的二氯代物有3种 B. x、y和z均能与溴水发生反应
C. z中的所有原子在同一平面上 D. x的同分异构体只有y和z两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 一定条件下反应N2+3H2![]() 2NH3,达到平衡时,3v正(H2)=2v正(NH3)
2NH3,达到平衡时,3v正(H2)=2v正(NH3)
B. 10mL浓度为1mol/L的盐酸与过量的Zn粉反应,若加入适量的CH3COONa溶液,既能降低反应速率,又不影响H2的生成
C. 将pH=a+1的氨水稀释为pH=a的过程中,c(OH-)/c(NH3H2O)变小
D. 25℃时,0.1 mol/L的NaHB溶液呈酸性,说明H2B为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水四氯化锡(SnCl4)可由下述反应制得:Sn+2Cl2==SnCl4。氯气是一种黄绿色的气体。纯的四氯化锡在常温下是无色液体,极易与水反应,在空气中与水蒸汽作用而冒白烟。下图是制备四氯化锡的装置图:

请回答下列问题:
(1)写出仪器b的名称_________________
(2)写出下列装置的作用:A________________、D________________、E________________。
(3)装好药品,并安装好仪器后,开始制备SnCl4的系列实验操作是_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知标准状况下气体摩尔体积为22.4L/mol,但很多化学实验并非在标准状况下进行,而是在常温常压下进行,下图为测定常温常压下气体摩尔体积的实验装置图。图中反应原理为:2C2H5OH+2Na→2C2H5ONa+H2↑(反应放热)。

(1)①该装置有明显错误处,请指出错误之处:_________;
②作图修改(只针对需修改部位):_____________。
(2)经过(1)改正后进行实验,实验过程如下:
a.检查装置气密性;
b.常温常压下,取4.6g乙醇与足量的金属钠反应并利用排水法收集产生的H2(假设广口瓶和量筒足够大);
c.当圆底烧瓶中不再有气泡产生,不能立即读数,必须先_____,后________,再平视读取量筒中收集到水的体积为1240.0mL。经计算常温常压下气体摩尔体积为__________。
(3)经过(1)改正后仍有实验误差,下列哪些选项会导致实验误差_______。
A.收集到的氢气中含有装置中原有的空气
B.收集H2前导管B中无蒸馏水
C.分液漏斗中的无水乙醇进入圆底烧瓶后占用了装置内气体空间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素R、X、Y、Z的原子序数依次增大。R和X可形成两种液态化合物(常温常压),Y+和X2-具有相同的电子层结构,X和Z位于同一主族。下列说法正确的是
A. 原子半径大小顺序为:r(Y)>r(X)>r(Z)>r(R)
B. R与X形成的两种液态化合物中均只含极性共价键
C. Y与X可形成碱性氧化物Y2X2
D. 由R、X、Y、Z四种元素形成的常见化合物可抑制水的电离
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com