
【题目】工业上常用铝土矿(主要成分为Al2O3,SiO2和Fe2O3等杂质)为原料制备铝氢化钠,铝氢化钠(NaAlH4)是有机合成的重要还原剂,工艺流程如下:
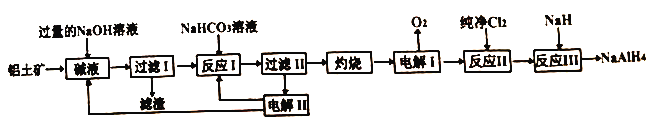 已知:SiO2在“碱液”中转化为铝硅酸钠Na2Al2SixO8)沉淀。
已知:SiO2在“碱液”中转化为铝硅酸钠Na2Al2SixO8)沉淀。
(1)过量NaOH溶液溶解铝土矿时为了提高浸出率可采取的措施是_______。(任写一种)
(2)电解I的化学方程式_______。
(3)“灼烧”操作用到的主要仪器有_______、_______、三脚架、玻璃棒、酒精灯、坩埚钳。
(4)“电解II”是电解Na2CO3溶液,原理如图所示。
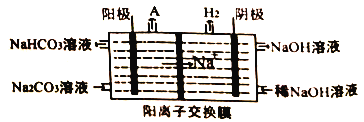
物质A为_______。(填化学式)
(5)反应III的化学方程式为_______,某同学经过分析认为可以再设计一个电解槽,电解_______ (填物质名称)溶液,更能实现副产物的循环利用。
(6)某同学认为该制备工艺也可以先酸溶,再加入NaOH溶液,当溶液中铁离子沉淀完全时,此时溶液pH是_______。(一般认为室温下离子浓度小于10-5mol/L时沉淀完全;Ksp[Fe(OH)3]=1×10-35,Ksp[Al(OH)3]=3×10-34)
【答案】 加热或粉碎矿石或适当增大NaOH溶液浓度 2Al2O3 ![]() 4Al+ 3O2↑ 坩埚 泥三角 O2 4NaH+AlCl3= NaAlH4+3NaCl 氯化钠 4
4Al+ 3O2↑ 坩埚 泥三角 O2 4NaH+AlCl3= NaAlH4+3NaCl 氯化钠 4
【解析】SiO2在“碱液”中转化为铝硅酸钠Na2Al2SixO8)沉淀,氧化铁与氢氧化钠不反应,氧化铝转化为偏铝酸钠,则过滤Ⅰ得到的滤渣是Na2Al2SixO8和Fe2O3。加入碳酸氢钠溶液,氢氧化钠转化为碳酸钠,偏铝酸钠转化为氢氧化铝沉淀和碳酸钠,过滤得到氢氧化铝,滤液是碳酸钠溶液;氢氧化铝灼烧转化为氧化铝,电解熔融氧化铝得到金属铝和氧气,铝与氯气化合生成氯化铝,氯化铝与NaH反应生成NaAlH4;则
(1)过量NaOH溶液溶解铝土矿时为了提高浸出率可采取的措施有:加热或粉碎矿石或适当增大NaOH溶液浓度等;(2)根据以上分析可知电解I的化学方程式为2Al2O3![]() 4Al+3O2↑。(3)“灼烧”固体氢氧化铝操作用到的主要仪器有坩埚、泥三角、三脚架、玻璃棒、酒精灯、坩埚钳。(4)阳极是氢氧根放电,则物质A为O2。(5)根据原子守恒可知反应III的化学方程式为4NaH+AlCl3=NaAlH4+3NaCl。由于反应中有氯化钠生成,电解氯化钠溶液生成氢气、氯气和氢氧化钠,更能实现副产物的循环利用。(6)根据氢氧化铁的溶度积常数可知当溶液中铁离子沉淀完全时,溶液中氢氧根的浓度是
4Al+3O2↑。(3)“灼烧”固体氢氧化铝操作用到的主要仪器有坩埚、泥三角、三脚架、玻璃棒、酒精灯、坩埚钳。(4)阳极是氢氧根放电,则物质A为O2。(5)根据原子守恒可知反应III的化学方程式为4NaH+AlCl3=NaAlH4+3NaCl。由于反应中有氯化钠生成,电解氯化钠溶液生成氢气、氯气和氢氧化钠,更能实现副产物的循环利用。(6)根据氢氧化铁的溶度积常数可知当溶液中铁离子沉淀完全时,溶液中氢氧根的浓度是![]() ,因此溶液pH是4。
,因此溶液pH是4。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 标准状况下,22.4L.NO和11.2L O2反应,生成气体的分子数目为NA
B. 将CuO和Cu2S等质量混合,混合物中Cu2+数目为NA
C. 1L.pH=12的NaOH溶液中的OH-数目为0.01NA
D. 0.1molT218O所含电子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨硼烷(NH3·BH3)电池可在常温下工作,装置如图所示。该电池工作时的总反应为:NH3·BH3+3H2O2=NH4BO2+4H2O。下列说法正确的是
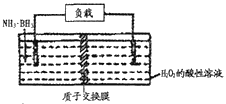
A. 正极附近溶液的pH减小
B. 电池工作时,H+通过质子交换膜向负极移动
C. 消耗3.1g氨硼烷,理论上通过内电路的电子为0.6ml
D. 负极电极反应为:NH3·BH3+2H2O-6e-= NH4++BO2-+6H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以2氯丙烷为主要原料制1,2丙二醇[CH3CH(OH)CH2OH]时,依次经过的反应类型为( )
A. 加成反应→消去反应→取代反应
B. 消去反应→加成反应→取代反应
C. 消去反应→取代反应→加成反应
D. 取代反应→加成反应→消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】POCl3是有机合成的催化剂,研究小组利用Cl2、PCl3和H2O在105~109℃下制备POCl3。
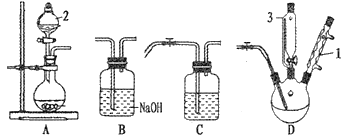
已知:①PCl3易被氧化易水解,沸点为76℃;②POCl3易水解,沸点为105.8℃。
(1)A装置制取氯气,仪器“2”的名称是______________,离子方程式为________。
(2)PCl3的电子式为____________,仪器“I”的作用是____________。
(3)仪器“3”装入的物质是________,当温度为105--109℃时,逐滴滴入。制备POCl3的化学反应方程式是________。
(4)制备POCl3的关键是必需保证m(Cl2)/m(H2O)≥3.94,当比值小于3.94时得不到POCl3,原因是_________________。
(5)装置连接顺序是A--_____,C中盛装的物质是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸工业尾气中的NO、NO2进入大气后,会形成光化学烟雾、破坏臭氧层等。可用氢氧化钠溶液对含氮氧化物的废气进行处理,反应的化学方程式如下:NO2+NO+2NaOH=2NaNO2+H2O;2NO2+2NaOH=NaNO2+NaNO3+H2O。氨气也可以用来处理氮氧化物。例如,氨气与一氧化氮可发生如下反应:4NH3+6NO=5N2+6H2O。将一定量NO和NO2的混合气体通入300mL5mol/LNaOH溶液中,恰好被完全吸收。下列说法不正确的是
A. 若用氨气处理,所需氨气在标准状况下的体积可能为22.4 L
B. 所得溶液中NaNO3和NaNO2的物质的量之比可能为1:2
C. 原混合气体中NO在标准状况下的体积可能为16. 8 L
D. 在用氨气处理氮氧化物时,氮氧化物发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A—L所代表的物质(溶液中的溶质),除F外其余均是中学化学里常见的物质,它们的转化关系如图所示(反应中部分产物及水已略去)。
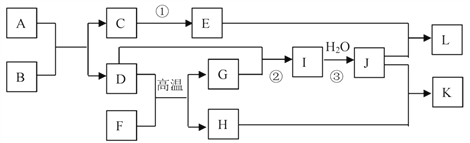
已知:a.通常状况下,A是淡黄色固体,B 是无色无味气体,D 是气体单质,H 是红棕色固体,L是白色胶状沉淀;b.反应①是工业生产普通玻璃的反应之一,反应②③是工业生产J的部分反应;c. F是由两种元素组成的化合物,其质量比为7:8;请填写下列空白:
(1)A的电子式__________。
(2)K的化学式_____________。
(3)完成下列反应方程式:
①D+G→I的化学方程式:_____________。
②E+J→L的离子方程式:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl﹣KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为PbSO4+2LiCl+Ca═ CaCl2+Li2SO4+Pb。下列有关说法正确的是

A. 正极反应式:Ca+2Cl-﹣2e-= CaCl2
B. 放电过程中,Li+向负极移动
C. 常温时,在正负极间接上电流表或检流计,指针发生偏转
D. 每转移0.1 mol电子,理论上生成10.35g Pb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中能用来区别SO2和CO2气体的是( ) ①澄清的石灰水
②氯水
③酸性高锰酸钾溶液
④氯化钡溶液
⑤品红溶液.
A.①④⑤
B.②③⑤
C.①②③
D.②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com