
【题目】化合物![]() (x)、
(x)、 (y)、
(y)、![]() (z)的分子式均为C8H8,下列说法正确的是
(z)的分子式均为C8H8,下列说法正确的是
A. y的二氯代物有3种 B. x、y和z均能与溴水发生反应
C. z中的所有原子在同一平面上 D. x的同分异构体只有y和z两种
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是 ( )
A. 25℃时 Cu(OH)2在水中的溶解度大于其在Cu(NO3)2溶液中的溶解度
B. 常温下,NaClO溶液显碱性的原因:ClO—+ H2O =" HClO" + OH—
C. 2NO(g) + 2CO(g) = N2(g) + 2CO2(g),在常温下能自发进行,则该反应的△H >0
D. 25℃时向水中加入少量NaOH后,由水电离出的c(H+)c(OH—)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以2氯丙烷为主要原料制1,2丙二醇[CH3CH(OH)CH2OH]时,依次经过的反应类型为( )
A. 加成反应→消去反应→取代反应
B. 消去反应→加成反应→取代反应
C. 消去反应→取代反应→加成反应
D. 取代反应→加成反应→消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸工业尾气中的NO、NO2进入大气后,会形成光化学烟雾、破坏臭氧层等。可用氢氧化钠溶液对含氮氧化物的废气进行处理,反应的化学方程式如下:NO2+NO+2NaOH=2NaNO2+H2O;2NO2+2NaOH=NaNO2+NaNO3+H2O。氨气也可以用来处理氮氧化物。例如,氨气与一氧化氮可发生如下反应:4NH3+6NO=5N2+6H2O。将一定量NO和NO2的混合气体通入300mL5mol/LNaOH溶液中,恰好被完全吸收。下列说法不正确的是
A. 若用氨气处理,所需氨气在标准状况下的体积可能为22.4 L
B. 所得溶液中NaNO3和NaNO2的物质的量之比可能为1:2
C. 原混合气体中NO在标准状况下的体积可能为16. 8 L
D. 在用氨气处理氮氧化物时,氮氧化物发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A—L所代表的物质(溶液中的溶质),除F外其余均是中学化学里常见的物质,它们的转化关系如图所示(反应中部分产物及水已略去)。
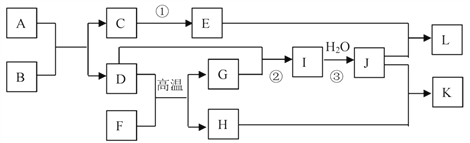
已知:a.通常状况下,A是淡黄色固体,B 是无色无味气体,D 是气体单质,H 是红棕色固体,L是白色胶状沉淀;b.反应①是工业生产普通玻璃的反应之一,反应②③是工业生产J的部分反应;c. F是由两种元素组成的化合物,其质量比为7:8;请填写下列空白:
(1)A的电子式__________。
(2)K的化学式_____________。
(3)完成下列反应方程式:
①D+G→I的化学方程式:_____________。
②E+J→L的离子方程式:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 常温下,在0.1mol·L-1的HNO3溶液中,由水电离出的c(H+)<![]()
B. 浓度为0.1mol·L-1的NaHCO3溶液:c(H2CO3)>c(CO32-)
C. 25℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同
D. 冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl﹣KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为PbSO4+2LiCl+Ca═ CaCl2+Li2SO4+Pb。下列有关说法正确的是

A. 正极反应式:Ca+2Cl-﹣2e-= CaCl2
B. 放电过程中,Li+向负极移动
C. 常温时,在正负极间接上电流表或检流计,指针发生偏转
D. 每转移0.1 mol电子,理论上生成10.35g Pb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铁和高铁酸钾都是常见的水处理剂。某兴趣小组以铁屑为原料模拟工业上制备氯化铁及进一步氧化制备高铁酸钾的流程如下:

请回答下列问题:
(1)“氧化”阶段通入过量空气比用氯气作氧化剂具有的优点是__________________________________。
(2)“合成”阶段生成Na2FeO4的离子方程式为__________________________________。
(3)为了检验“氧化”过程中所得FeCl3溶液中是否含有Fe2+,某同学取少量溶液于试管中,选用下列试剂可以达到目的的是_______(填字母)。
a.KSCN溶液 b.NaOH溶液 c.K3[Fe(CN)6]溶液 d.苯酚溶液
若选用酸性K MnO4溶液进行检验,请分析方案是否合理,并说明理由:_____________________________。
(4)过程①制取FeCl3固体的具体操作步骤是_____________________________________________________。若使6.4mol/LFeCl3饱和溶液不析出Fe(OH)3,需控制溶液的pH小于_______{已知该实验条件下,Ksp[(Fe(OH)3]=8.5×10-36,Kw=1.1×10-13,1.13≈1.33}
(5)在不同温度和不同pH下,FeO42-的稳定性如下图所示:

从上图分析,为了提高“合成”阶段Na2FeO4的产率,可采取的实验条件范围为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠、氯及其化合物有如下转化关系,请按要求填空:

(1)Na、Na2O、Na2O2、NaOH久置空气中最终都是变为____________(填化学式);
(2)Na放在石棉网上加热反应的化学方程式为______________________________
(3)Na2O2与水反应的化学方程式为__________________________________
(4)一小块金属钠投入CuCl2溶液中,发生反应的方程式有:___________,和_________________________________________________________________.
(5)在点燃的条件下Fe 与Cl2发生反应的现象为_____________________________________________,反应的化学方程式为______________________________________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com