
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题。
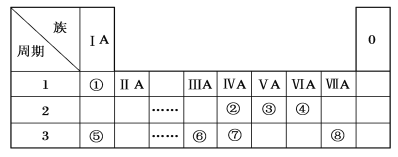
(1)③、④、⑤、⑥的离子半径由大到小的顺序是________。(用离子符号表示)
(2)①、③、④、⑥元素可形成多种含10个电子的微粒,其中A和B为分子,C和E为阳离子,D为阴离子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀。请写出B、D微粒的电子式:B_______,D________。
并写出A、B、E三种微粒反应的离子方程式____________________________。
(3)由④⑤⑧三种元素组成的某种盐是家用消毒液的主要成分,将该盐溶液滴入KI淀粉溶液中溶液变为蓝色,则反应的离子方程式为________________________。
【答案】N3->O2->Na+>Al3+ ![]()
![]() Al3+ +3NH3+3H2O=Al(OH)3↓+3NH4+ ClO-+2I-+H2O=Cl-+I2+2OH-
Al3+ +3NH3+3H2O=Al(OH)3↓+3NH4+ ClO-+2I-+H2O=Cl-+I2+2OH-
【解析】
根据元素在周期表中的位置关系可知,①、②、③、④、⑤、⑥、⑦和⑧分别是H、C、N、O、Na、Al、Si和Cl,再结合元素周期律与物质结构与性质作答,
(1)四种元素对应的简单离子电子层数相同,依据离子半径规律作答;
(2)①、③、④、⑥元素可形成多种含10个电子的微粒,其中A和B为分子,C为阳离子,D为阴离子,B溶于A后所得的物质可电离出C和D,则可知涉及的反应为氨气溶于水后生成一水合氨,可电离出铵根离子与氢氧根离子,则推出B为氨气,A为水,C为铵根离子,D为氢氧根离子;又A、B、E三种微粒反应后可得C和一种白色沉淀,则可知E为氯离子,涉及的离子反应为铝离子与一水合氨反应生成氢氧化铝沉淀与铵根离子,据此分析作答;
(3)由④⑤⑧三种元素组成的某种盐是家用消毒液的主要成分,则该盐为NaClO,将该盐溶液滴入KI淀粉溶液中溶液变为蓝色,发生氧化还原反应,据此分析。
根据上述分析可知,①、②、③、④、⑤、⑥、⑦和⑧分别是H、C、N、O、Na、Al、Si和Cl,
(1)电子层数相同时,核电荷数越小,离子半径越大,则③、④、⑤、⑥的离子半径由大到小的顺序是N3->O2->Na+>Al3+;
(2)根据上述分析可知B为氨气,其电子式为:![]() ;D为氢氧根离子,其电子式为:
;D为氢氧根离子,其电子式为:![]() ;
;
A、B、E三种微粒反应的离子方程式为:Al3+ +3NH3+3H2O=Al(OH)3↓+3NH4+;
(3)由④⑤⑧三种元素组成的NaClO与KI发生氧化还原反应,其离子方程式为:ClO-+2I-+H2O=Cl-+I2+2OH-。


科目:高中化学 来源: 题型:
【题目】0.2mol某有机物和0.2mol O2在密闭容器中恰好完全反应,生成CO2、CO和H2O。将该混合气体依次通过浓硫酸、灼热的CuO和碱石灰后(假设每一步均充分反应),浓硫酸增重7.2g,CuO固体质量减少3.2g,而碱石灰增重17.6g。
(1)产物的物质的量为:n(H2O)=____mol,n(CO)=____mol,n(CO2)=____mol。
(2)该有机物的分子式为________。
(3)等量的该有机物分别与Na和NaHCO3反应,均产生气体,且在同温同压下生成的气体体积相同,则该有机物所含官能团名称为__________,该有机物的结构简式为_________。
(4)写出该有机物与乙醇发生酯化反应的化学方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在元素周期表中,A、B均为前四周期主族元素,且A位于B的下一周期。某含氧酸盐X的化学式为ABO3。请回答:
(1)若常温下B的单质为黄绿色气体。
①A在元素周期表中的位置是_______________________。
②下列说法正确的是_________(填代号)。
a.A单质的熔点比B单质的熔点低
b.A的简单离子半径比B的简单离子半径大
c.A、B元素的最高价氧化物对应的水化物都是强电解质
d.化合物X中既含有离子键又含有共价键
③400℃时,X能发生分解反应生成两种盐,其物质的量之比为1∶3,其中一种是无氧酸盐。该反应的化学方程式为_____________________________________________。
(2)若X能与稀硫酸反应,生成无色、无味的气体。
①该气体分子的电子式为______________________。
②X在水中持续加热,发生水解反应,生成一种更难溶的物质并逸出气体,反应的化学方程式为__________________________________________。
③X可用作防火涂层,其原因是:a.高温下X发生分解反应时,吸收大量的热;
b. __________________________________________(任写一种)。
(3)若X难溶于水,在空气中易氧化变质,B元素原子的最外层电子数是其电子层数的2倍。X能快速消除自来水中的C1O-,该反应的离子方程式为______________________________________。
(4)用一个化学方程式证明上述(1)、(3)两种情况下化合物X中B元素非金属性强弱________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】道路千万条,安全第一条,行车不规范,亲人两行泪。减少交通事故除遵守交通法规正确驾驶外,安全措施也极为重要。汽车的安全气嚢内一般充入的是叠氮化钠(NaN3)、硝酸铵(NH4NO3)、硝酸钾(KNO3)等物质。当汽车在高速行驶中受到猛烈撞击时,这些物质会迅速发生分解或发生反应,产生大量气体,充满气囊,从而保护驾驶员和乘客的安全。
请回答下列问题:
(1)下列判断正确的是_______。
A.道路起雾与H2O分子的化学键断裂有关
B.NH4NO3、KNO3中含有化学键的类型完全相同
C.NaN3不会和酸性高锰酸钾或次氯酸钠溶液反应
D.NaN3、NH4NO3固体在储存和使用时都必须格外小心,以免发生爆炸
(2)汽车的安全气囊内叠氮化钠爆炸过程中的能量变化如图所示:
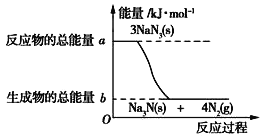
①叠氮化钠的爆炸反应属于_______(填“吸热”或“放热”)反应。
②若爆炸过程中有30mol 非极性键生成(一个共用电子对为一个化学健),则反应的能量变化为____kJ(用含a、b的代数式表示),消耗叠氮化钠的质量为_________g。
(3)若安全气囊内充的是叠氮酸钠和硝酸钾,撞击时发生的反应是10NaN3+2KNO3=K2O+5Na2O+16N2↑。当该反应的氧化产物比还原产物多1.4mol,则转移电子的物质的量是________mol,同时气囊内还必须充入一定量的SiO2粉末,其在安全气囊内所起的作用可能是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:RCH2COOH![]() RCHClCOOH、
RCHClCOOH、![]() 。
。
Ⅰ.冠心平F是降血脂、降胆固醇的药物,它的一条合成路线如下:
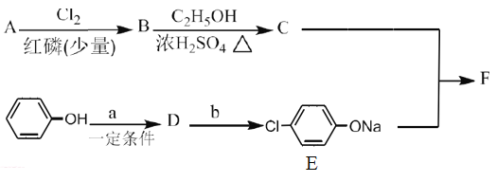
(1)A为一元羧酸,8.8gA与足量NaHCO3溶液反应生成2.24LCO2(标准状况),A的分子式为__________。
(2)写出符合A分子式的所有甲酸酯的结构简式:__________。
(3)B是氯代羧酸,其核磁共振谱有两个峰,写出B→C的反应方程式:__________。
(4)C+E→F的反应类型为__________。
(5)写出A和F的结构简式:A.__________;F.__________。
(6)D的苯环上有两种氢,它所含官能团的名称为__________;写出a、b所代表的试剂:a.__________;b.__________。
Ⅱ.(7)有机物H的分子式为C2H2O3,可发生银镜反应,且具有酸性H有多种合成方法,在方框中写出由乙酸合成H的路线流程图(其他原料任选)。_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~I分别表示中学化学中常见的一种物质,其中A、I为常见金属,它们之间的相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。请填写下列空白:

(1)A、B、C、D、E、F六种物质中所含同一种元素在周期表中的位置是________。
(2)写出C物质的化学式:________。
(3)写出①、⑥反应的化学方程式:
①:____________________________。
⑥:____________________________。
(4)从能量变化的角度看,反应①②③中,属于放热反应的是________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇脱氢可制取甲醛:CH3OH(g) ![]() HCHO(g)+H2(g)+Q,甲醇的平衡转化率随温度变化曲线如图所示。下列有关说法正确的是( )
HCHO(g)+H2(g)+Q,甲醇的平衡转化率随温度变化曲线如图所示。下列有关说法正确的是( )
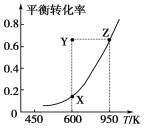
A. Q>0
B. 600 K时,Y点甲醇的v(正)<v(逆)
C. 从Y点到Z点可通过增大压强实现
D. 从Y点到X点可通过使用催化剂实现
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com