
【题目】A~I分别表示中学化学中常见的一种物质,其中A、I为常见金属,它们之间的相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。请填写下列空白:

(1)A、B、C、D、E、F六种物质中所含同一种元素在周期表中的位置是________。
(2)写出C物质的化学式:________。
(3)写出①、⑥反应的化学方程式:
①:____________________________。
⑥:____________________________。
(4)从能量变化的角度看,反应①②③中,属于放热反应的是________(填序号)。
【答案】第四周期 第Ⅷ族 FeCl2 3Fe3O4+8Al![]() 9Fe+4Al2O3 4Fe(OH)2+O2+2H2O= 4Fe(OH)3 ①②
9Fe+4Al2O3 4Fe(OH)2+O2+2H2O= 4Fe(OH)3 ①②
【解析】
G为主族元素的固态氧化物,可以和氢氧化钠反应,判断为两性氧化物,应为Al2O3,与NaOH反应生成NaAlO2,则J为NaAlO2,电解生成O2和Al,又A、I为常见金属,由反应④可知,I为Al,则H为O2,F为红褐色沉淀,则应为Fe(OH)3,则D为FeCl3,E为Fe(OH)2,C为FeCl2,所以B为Fe3O4,与Al在高温下发生铝热反应生成A,A为Fe,根据物质的性质可进一步书写有关反应的化学方程式,据此分析作答。
根据上述分析可知,A、B、C、D、E、F、G、H、I和J分别是Fe、 Fe3O4、 FeCl2、 FeCl3、 Fe(OH)2、Fe(OH)3、O2、Al和NaAlO2,则
(1)A、B、C、D、E、F六种物质中所含同一种元素为Fe,在元素周期表中的位置为:第四周期 第Ⅷ族;
(2)C为FeCl2;
(3)反应①是Fe3O4与Al高温下制备Fe的过程,其化学方程式为:3Fe3O4+8Al![]() 9Fe+4Al2O3;反应⑥是Fe(OH)2转化为Fe(OH)3的过程,其化学方程式为4Fe(OH)2+O2+2H2O= 4Fe(OH)3,故答案为:3Fe3O4+8Al
9Fe+4Al2O3;反应⑥是Fe(OH)2转化为Fe(OH)3的过程,其化学方程式为4Fe(OH)2+O2+2H2O= 4Fe(OH)3,故答案为:3Fe3O4+8Al![]() 9Fe+4Al2O3;4Fe(OH)2+O2+2H2O= 4Fe(OH)3;
9Fe+4Al2O3;4Fe(OH)2+O2+2H2O= 4Fe(OH)3;
(4)反应①铝热反应属于放热反应,反应②Fe的燃烧反应属于放热反应,反应③电解熔融氧化铝为吸热反应,则属于放热反应的是:①②。


科目:高中化学 来源: 题型:
【题目】(题文)(题文)由芳香烃A制备某种药物H的合成路线如下图所示:
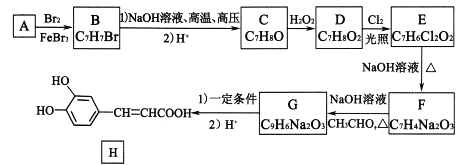
己知:①有机物B苯环上只有两种不同环境的氢原子;
②两个羟基连在同一碳上不稳定,易脱水形成羰基或醛基;
③![]()
④
(1)有机物B的名称为 ____。
(2) 1molH与浓溴水反应,最多消耗_______ mol Br2。
(3)由G生成H所需的“一定条件”为________。
(4)写出E转化为F的化学方程式:____
(5)请仿照上述合成路线,设计由![]() 和丙醛
和丙醛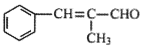 合成的流程图:_____其他试剂任选)。
合成的流程图:_____其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g)中,4 mol HCl被氧化,放出115.6 kJ的热量。又知:
2Cl2(g)+2H2O(g)中,4 mol HCl被氧化,放出115.6 kJ的热量。又知:![]() ,判断下列说法正确的是( )
,判断下列说法正确的是( )
A. 该反应的ΔH=+115.6 kJ·mol-1
B. 断开1 mol H—O 键与断开1 mol H—Cl 键所需能量相差约为32 kJ
C. H2O中H—O 键比HCl中H—Cl键弱
D. 由所提供数据判断氯元素的非金属性比氧元素强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题。
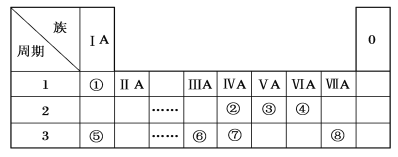
(1)③、④、⑤、⑥的离子半径由大到小的顺序是________。(用离子符号表示)
(2)①、③、④、⑥元素可形成多种含10个电子的微粒,其中A和B为分子,C和E为阳离子,D为阴离子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀。请写出B、D微粒的电子式:B_______,D________。
并写出A、B、E三种微粒反应的离子方程式____________________________。
(3)由④⑤⑧三种元素组成的某种盐是家用消毒液的主要成分,将该盐溶液滴入KI淀粉溶液中溶液变为蓝色,则反应的离子方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 《元丰行示德逢》里“雷蟠电掣云滔滔,夜半载雨输亭皋”涉及化学反应N2+O2![]() 2NO
2NO
B. 检验久置 Na2SO3是否变质,可用BaCl2溶液和稀硝酸
C. SO2通入BaCl2溶液中会产生白色沉淀
D. 将铜片放入浓硫酸中,无明显现象是因为铜片发生了钝化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关系如图所
示:
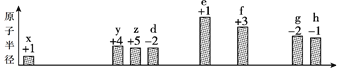
原子序数
下列说法不正确的是( )
A. x、z、d三种元素能形成具有强氧化性的酸
B. 根据g、h的单质与Fe反应的情况,可以判断h的非金属性大于g
C. 工业上通过电解f、h形成的化合物制取f 单质
D. x与其他元素可形成共价化合物或离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组以废铁屑制得硫酸亚铁铵后,按下列流程制备二水合草酸亚铁(FeC2O4·2H2O),进一步制备高纯度还原铁粉。

已知:FeC2O4·2H2O难溶于水,150℃开始失结晶水;H2C2O4易溶于水,溶解度随温度升高而增大。
请回答:
(1)下列操作或描述正确的是__________。
A.步骤②,H2C2O4稍过量主要是为了抑制Fe2+水解
B.步骤③,采用热水洗涤可提高除杂效果
C.步骤③,母液中的溶质主要是(NH4)2SO4 和H2C2O4
D.步骤③,如果在常压下快速干燥,温度可选择略高于100℃
(2)如图装置,经过一系列操作完成步骤③中的抽滤和洗涤。请选择合适的编号,按正确的操作顺序补充完整(洗涤操作只需考虑一次):
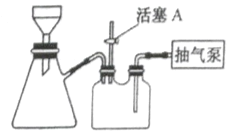
开抽气泵→a→b→d→_________→c→关抽气泵
a.转移固液混合物; b.关活塞A; c.开活塞A; d.确认抽干; e.加洗涤剂洗涤。
(3)称取一定量的FeC2O4·2H2O试样,用硫酸溶解,采用KMnO4滴定法测定,折算结果如下:
n (Fe2+)/mol | n (C2O42-)/mol | 试样中FeC2O4·2H2O的质量分数 |
9.80×10-4 | 9.80×10-4 | 0.980 |
由表中数据推测试样中最主要的杂质是___________
(4)实现步骤④必须用到的两种仪器是_________(供选仪器:a.烧杯;b.坩埚;c.蒸馏烧瓶;d.高温炉;e.表面皿;f.锥形瓶);该步骤的化学方程式是______________________。
(5)为实现步骤⑤,不宜用碳粉还原Fe2O3,理由是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在左试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2 mL乙酸,充分摇匀。在右试管中加入5mL饱和Na2CO3溶液。按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验。
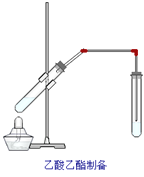
(1)写出左试管中主要反应的方程式:____________________;
(2)加入浓硫酸的作用:_________________________;
(3)饱和Na2CO3的作用是:____________;__________________;__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com