
【题目】如图,在左试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2 mL乙酸,充分摇匀。在右试管中加入5mL饱和Na2CO3溶液。按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验。
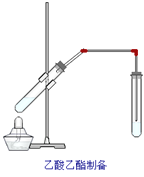
(1)写出左试管中主要反应的方程式:____________________;
(2)加入浓硫酸的作用:_________________________;
(3)饱和Na2CO3的作用是:____________;__________________;__________________。
【答案】CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O 催化剂和吸水剂 吸收多余的乙酸 溶解多余的乙醇 降低乙酸乙酯的溶解性
CH3COOCH2CH3+H2O 催化剂和吸水剂 吸收多余的乙酸 溶解多余的乙醇 降低乙酸乙酯的溶解性
【解析】
(1)醋酸和乙醇在浓硫酸催化作用下发生酯化反应,生成乙酸乙酯和水;
(2)浓硫酸做酯化反应的催化剂和吸水剂;
(3)实验室里用饱和碳酸钠溶液吸收乙酸乙酯的原因:一是利用碳酸钠溶液中的水溶解乙醇(乙醇在水里的溶解度大于乙酸乙酯),二是碳酸钠能跟乙酸反应吸收乙酸,便于闻到乙酸乙酯的香味,而乙酸乙酯难溶于饱和碳酸钠溶液,这样就可以获得较为纯净的乙酸乙酯液体。
(1)乙酸和乙醇在浓硫酸催化作用下发生酯化反应,生成乙酸乙酯和水,反应的化学方程式为:CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;
(2)浓硫酸有吸水性,促进该反应向正反应方向移动,浓硫酸能加快反应速率,所以浓硫酸作催化剂和吸水剂;
(3)碳酸钠溶液能溶解乙醇,能跟乙酸反应吸收乙酸,降低乙酸乙酯的溶解度,便于分层,故答案为:吸收多余的乙酸、溶解多余的乙醇、降低乙酸乙酯的溶解性。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】A~I分别表示中学化学中常见的一种物质,其中A、I为常见金属,它们之间的相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。请填写下列空白:

(1)A、B、C、D、E、F六种物质中所含同一种元素在周期表中的位置是________。
(2)写出C物质的化学式:________。
(3)写出①、⑥反应的化学方程式:
①:____________________________。
⑥:____________________________。
(4)从能量变化的角度看,反应①②③中,属于放热反应的是________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁触媒是重要的催化剂,CO易与铁触媒作用导致其失去催化活性:Fe+5CO=Fe(CO)5;除去CO的化学反应为:[Cu(NH3)2]OOCCH3+CO+NH3=[Cu(NH3)3(CO)]OOCCH3。
(1)基态Fe原子的外围电子排布式:________,C、N、O的第一电离能由大到小的顺序为________。
(2)Fe(CO)5又名羰基铁,常温下为黄色油状液体,则Fe(CO)5的晶体类型是_______,与CO互为等电子体的分子的电子式为______________。
(3)硝酸钾中NO3-的空间构型_______,分子中的大π键可用符号![]() 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为![]() ),则NO3-中的大π键应表示为____________。
),则NO3-中的大π键应表示为____________。
(4)配合物[Cu(NH3)2]OOCCH3中碳原子的杂化类型是________,配位体中提供孤对电子的原子是_____。
(5)用[Cu(NH3)2]OOCCH3除去CO的反应中,肯定有______形成.
a.离子键 b.配位键 c.非极性键 d.σ键
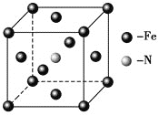
(6)铁和氨气在640 ℃可发生置换反应,产物之一的晶胞结构如图所示,写出该反应的化学方程式__________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的NaOH溶液,下列操作会造成结果偏高的是( )
A.称量固体NaOH时,有潮解现象B.溶解后移液至容量瓶中,未冷却溶液
C.未将洗涤烧杯的水转移至容量瓶中D.定容时仰视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇脱氢可制取甲醛:CH3OH(g) ![]() HCHO(g)+H2(g)+Q,甲醇的平衡转化率随温度变化曲线如图所示。下列有关说法正确的是( )
HCHO(g)+H2(g)+Q,甲醇的平衡转化率随温度变化曲线如图所示。下列有关说法正确的是( )
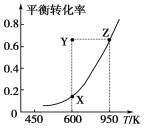
A. Q>0
B. 600 K时,Y点甲醇的v(正)<v(逆)
C. 从Y点到Z点可通过增大压强实现
D. 从Y点到X点可通过使用催化剂实现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔是重要的化工原料,广泛用于有机合成和氧炔焊等。生产乙炔的方法有多种,如电石法、甲烷裂解法等。
(1)在Co(NO3)2催化下,乙炔可被50%的浓硝酸(硝酸被还原为NO2)在20~70℃时直接氧化为H2C2O4·2H2O。
①该反应的化学方程式为____________________________________________________;
②实际生产中硝酸可循环利用而不被消耗,用方程式说明:__________________。
(2)电石法原理为:由石油焦与生石灰在电炉中生成电石CaC2(含Ca3P2、CaS等杂质),电石与水反应生成C2H2(含PH3及H2S等杂质)。
①已知焦炭固体与氧化钙固体每生成l g CaC2固体,同时生成CO气体吸收7.25kJ的热量,则该反应的热化学方程式为______________________________________________;
②用CuSO4溶液净化乙炔气体,去除PH3的反应之一为:
4CuSO4+PH3+4H2O==4Cu↓+H3PO4+4H2SO4,每去除1 mol PH3,该反应中转移电子的物质的量为__________;
③电石法工艺流程简单、容易操作、乙炔纯度高,缺点是___________________(举1例)。
(3)甲烷裂解法原理为:2CH4(g)![]() C2H2(g)+3H2(g) △H,实验测得该反应的Kp(用平衡分压代替浓度计算的平衡常数,分压=总压×物质的量分数)与温度的关系如下图所示:
C2H2(g)+3H2(g) △H,实验测得该反应的Kp(用平衡分压代替浓度计算的平衡常数,分压=总压×物质的量分数)与温度的关系如下图所示:
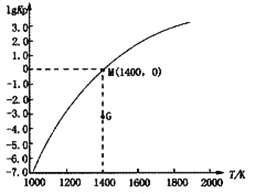
①该反应的△H________0(填“>”、“=”或“<”);
②图中G点v(正)______v(逆)(填“>”、“=”或“<”);
③M点时,若容器中气体的总物质的量为1 mol,CH4、C2H2及H2的物质的量分别为a、b、c,则总压P与a、b、c之间的关系为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究人员从木耳菜中提取过氧化物酶(POD),分别与四种不同酚类物质及H2O2进行催化反应,结果如图所示。下列相关说法正确的是
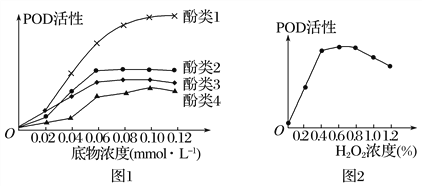
A. 图1所示的实验目的是探究不同酚类物质的浓度对POD活性的影响
B. 当底物浓度为0.08 mmolL-1时,POD催化酚类2的反应速率一定大于酚类3
C. 由图2可知,H2O2浓度过高会抑制POD的活性,降低浓度后POD的活性一定会恢复
D. H2O2对POD活性的影响与温度和pH对POD活性的影响相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银锌电池广泛用作于各种电子仪器的电源。它的充电放电过程可表示为:2Ag+Zn(OH)2![]() Ag2O +Zn+H2O,
Ag2O +Zn+H2O,
回答下列有关问题:
(1)电池的放电过程是________(填“①”或“②”)。
(2)该电池属于________(填“酸”“碱”或“中”)性电池。
(3)反应①是________(填“放热”或“吸热”)反应。
(4)写出充电时的电极反应式:
阳极:______________________,
阴极:______________________。
(5)充电时,电池的阳极应接电源的________极。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com