
【题目】某兴趣小组以废铁屑制得硫酸亚铁铵后,按下列流程制备二水合草酸亚铁(FeC2O4·2H2O),进一步制备高纯度还原铁粉。

已知:FeC2O4·2H2O难溶于水,150℃开始失结晶水;H2C2O4易溶于水,溶解度随温度升高而增大。
请回答:
(1)下列操作或描述正确的是__________。
A.步骤②,H2C2O4稍过量主要是为了抑制Fe2+水解
B.步骤③,采用热水洗涤可提高除杂效果
C.步骤③,母液中的溶质主要是(NH4)2SO4 和H2C2O4
D.步骤③,如果在常压下快速干燥,温度可选择略高于100℃
(2)如图装置,经过一系列操作完成步骤③中的抽滤和洗涤。请选择合适的编号,按正确的操作顺序补充完整(洗涤操作只需考虑一次):
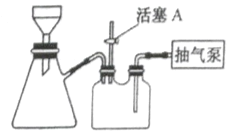
开抽气泵→a→b→d→_________→c→关抽气泵
a.转移固液混合物; b.关活塞A; c.开活塞A; d.确认抽干; e.加洗涤剂洗涤。
(3)称取一定量的FeC2O4·2H2O试样,用硫酸溶解,采用KMnO4滴定法测定,折算结果如下:
n (Fe2+)/mol | n (C2O42-)/mol | 试样中FeC2O4·2H2O的质量分数 |
9.80×10-4 | 9.80×10-4 | 0.980 |
由表中数据推测试样中最主要的杂质是___________
(4)实现步骤④必须用到的两种仪器是_________(供选仪器:a.烧杯;b.坩埚;c.蒸馏烧瓶;d.高温炉;e.表面皿;f.锥形瓶);该步骤的化学方程式是______________________。
(5)为实现步骤⑤,不宜用碳粉还原Fe2O3,理由是________________。
【答案】BD c→e→b→d (NH4)2SO4 bd 4FeC2O4·2H2O+3O2![]() 2Fe2O3+8CO2+8H2O 用炭粉还原会进杂质
2Fe2O3+8CO2+8H2O 用炭粉还原会进杂质
【解析】
硫酸亚铁铵晶体溶解于水,为保证Fe2+完全反应,同时防止Fe2+被氧化,需要加入过量的草酸,生成的草酸亚铁晶体(FeC2O4·2H2O)难溶于水,可通过抽滤、洗涤并干燥获得,将所得晶体在空气中灼烧,得纯氧化铁(Fe2O3),再用CO还原氧化铁得到还原铁粉,据此解答。
硫酸亚铁铵晶体溶解于水,为保证Fe2+完全反应,同时防止Fe2+被氧化,需要加入过量的草酸,生成的草酸亚铁晶体(FeC2O4·2H2O)难溶于水,可通过抽滤、洗涤并干燥获得,将所得晶体在空气中灼烧,得纯氧化铁(Fe2O3),再用CO还原氧化铁得到还原铁粉;
(1)A项,步骤①溶解酸化后溶液已呈酸性,故步骤②时H2C2O4稍过量的主要目的不是酸化抑制Fe2+水解,而是保证Fe2+完全转化为草酸亚铁晶体,同时防止Fe2+被氧化,提高原料利用率,故A项错误;
B项,步骤③,采用热水洗涤可提高草酸的溶解度,提升除杂效果,故B项正确;
C项,酸化和加入稍过量的H2C2O4后,发生反应(NH4)2Fe(SO4)2+ H2C2O4+2H2O= FeC2O4·2H2O↓+(NH4)2SO4+H2SO4,故母液中的溶质主要有(NH4)2SO4、H2SO4和H2C2O4,故C项错误;
D项,根据题给信息,FeC2O4·2H2O 在150℃开始失结晶水,故略高于100℃不影响产物的成分,为使FeC2O4·2H2O快速干燥,可使温度高于100℃,但须低于150℃,故D项正确;
综上所述,本题正确答案为BD。
(2)抽滤完成后,需要洗涤晶体,故应该先打开活塞A,使吸滤瓶内的压强回升,然后添加洗涤剂,待洗涤剂缓慢通过晶体后关闭活塞A,再次确认抽干,打开活塞A防止发生倒吸,最后关闭气泵,正确的顺序为开抽气泵→转移固液混合物→关活塞A→确认抽干→关活塞A→确认抽干→开活塞A→关抽气泵,
故答案为:c→e→b→d;
(3)由图表数据可知,溶液中已知Fe2+和C2O42-的浓度满足电荷守恒,说明杂质中不存在Fe2+或C2O42-,那杂质只能是反应的另一种生成物(NH4)2SO4。
故答案为:(NH4)2SO4;
(4)固体灼烧需要在坩埚内进行,则所需要的仪器有坩埚及加热所需的高温炉,用到的两种仪器是bd;草酸亚铁和O2灼烧时发生反应的化学方程式为4FeC2O4·2H2O+3O2![]() 2Fe2O3+8CO2+8H2O 。
2Fe2O3+8CO2+8H2O 。
故答案为:bd;4FeC2O4·2H2O+3O2![]() 2Fe2O3+8CO2+8H2O ;
2Fe2O3+8CO2+8H2O ;
(5)步骤⑤选用碳粉还原Fe2O3,多余的碳粉会影响铁粉的纯度。
故答案为:用炭粉还原会引进杂质。


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】已知:2X(g)+Y(g)![]() 2Z(g),反应中ω(Z的物质的量分数)随温度T的变化如下图所示。下列判断正确的是( )
2Z(g),反应中ω(Z的物质的量分数)随温度T的变化如下图所示。下列判断正确的是( )
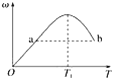
A. T1时,v正>v逆
B. 正反应的ΔH<0
C. a、b两点的反应速率v(a)=v(b)
D. 当温度低于T1时,ω增大的原因是平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~I分别表示中学化学中常见的一种物质,其中A、I为常见金属,它们之间的相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。请填写下列空白:

(1)A、B、C、D、E、F六种物质中所含同一种元素在周期表中的位置是________。
(2)写出C物质的化学式:________。
(3)写出①、⑥反应的化学方程式:
①:____________________________。
⑥:____________________________。
(4)从能量变化的角度看,反应①②③中,属于放热反应的是________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用含结晶水的正盐X(四种短周期元素组成的纯净物)进行了如下实验:
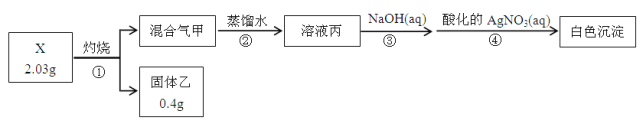
实验中观测到:混合气甲呈无色并被蒸馏水全部吸收;固体乙为纯净物;在步骤③中,取1/10溶液丙,恰好中和需消耗0.00200molNaOH;另取一定量的溶液丙,加入少量K2FeO4固体,产生黄绿色气体。
请回答:
(1)X的化学式是__________,步骤①的化学方程式是______________________________。
(2)溶液丙与K2FeO4固体反应的化学方程式是_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组按下列路线合成抗抑郁药物吗氯贝胺
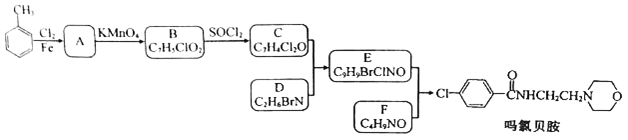
已知:
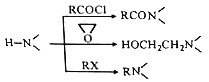
请回答:
(1)下列说法不正确的是________。
A. 化合物A能发生还原反应 B. 化合物B能与碳酸氢钠反应产生气体
C. 化合物D具有碱性 D. 吗氯贝胺的化学式是C13H13ClN2O2
(2)化合物F的结构简式是_____________。
(3)写出C+D→E的化学方程式______________________。
(4)为探索新的合成路线,发现用化合物C与X(C6H14N2O)一步反应即可合成吗氯贝胺。请设计以环氧乙烷(![]() )为原料合成X的合成路线___________(用流程图表示,无机试剂任选)。
)为原料合成X的合成路线___________(用流程图表示,无机试剂任选)。
(5)写出化合物X(C6H14N2O)可能的同分异构体的结构简式_____________。须同时符合:①分子中有一个六元环,且成环原子中最多含一个非碳原子。②1H-NMR谱显示分子中有5种氢原子;IR谱表明分子中有N-N键,无 O-H键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁触媒是重要的催化剂,CO易与铁触媒作用导致其失去催化活性:Fe+5CO=Fe(CO)5;除去CO的化学反应为:[Cu(NH3)2]OOCCH3+CO+NH3=[Cu(NH3)3(CO)]OOCCH3。
(1)基态Fe原子的外围电子排布式:________,C、N、O的第一电离能由大到小的顺序为________。
(2)Fe(CO)5又名羰基铁,常温下为黄色油状液体,则Fe(CO)5的晶体类型是_______,与CO互为等电子体的分子的电子式为______________。
(3)硝酸钾中NO3-的空间构型_______,分子中的大π键可用符号![]() 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为![]() ),则NO3-中的大π键应表示为____________。
),则NO3-中的大π键应表示为____________。
(4)配合物[Cu(NH3)2]OOCCH3中碳原子的杂化类型是________,配位体中提供孤对电子的原子是_____。
(5)用[Cu(NH3)2]OOCCH3除去CO的反应中,肯定有______形成.
a.离子键 b.配位键 c.非极性键 d.σ键
(6)铁和氨气在640 ℃可发生置换反应,产物之一的晶胞结构如图所示,写出该反应的化学方程式__________________ 。
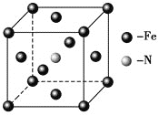
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的NaOH溶液,下列操作会造成结果偏高的是( )
A.称量固体NaOH时,有潮解现象B.溶解后移液至容量瓶中,未冷却溶液
C.未将洗涤烧杯的水转移至容量瓶中D.定容时仰视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究人员从木耳菜中提取过氧化物酶(POD),分别与四种不同酚类物质及H2O2进行催化反应,结果如图所示。下列相关说法正确的是
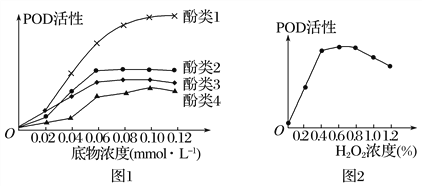
A. 图1所示的实验目的是探究不同酚类物质的浓度对POD活性的影响
B. 当底物浓度为0.08 mmolL-1时,POD催化酚类2的反应速率一定大于酚类3
C. 由图2可知,H2O2浓度过高会抑制POD的活性,降低浓度后POD的活性一定会恢复
D. H2O2对POD活性的影响与温度和pH对POD活性的影响相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com