
【题目】常温下,下列物质的水溶液pH大于7的是( )
A.KHSO4B.CH3COONaC.NH4NO3D.Al2(SO4)3
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某工业流程中,进入反应塔的混合气体中NO和O2的物质的量分数分别为0.10和0.06,发生化学反应2NO(g)+O2(g)=2NO2(g),在其他条件相同时,测得实验数据如下表:
压强/(×105Pa) | 温度/℃ | NO达到所列转化率需要时间/s | ||
50% | 90% | 98% | ||
1.0 | 30 | 12 | 250 | 2830 |
90 | 25 | 510 | 5760 | |
8.0 | 30 | 0.2 | 3.9 | 36 |
90 | 0.6 | 7.9 | 74 | |
根据表中数据,下列说法正确的是
A. 升高温度,反应速率加快
B. 增大压强,反应速率变慢
C. 在1.0×105Pa、90℃条件下,当转化率为98%时的反应已达到平衡
D. 若进入反应塔的混合气体为amol,反应速率以v=△n/△t表示,则在8.0×105Pa、30℃条件下转化率从50%增至90%时段NO的反应速率为4a/370mol/s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用60 g乙酸和46 g乙醇反应,如果实际产率是理论产率的一半,则可得到的乙酸乙酯的质量是( )
A. 29.5gB. 44 gC. 74.8 gD. 88 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镉镍可充电电池在现代生活中有广泛应用,它的充、放电反应按下式进行:Cd+2NiOOH+2H2O![]() Cd(OH)2+2Ni(OH)2 ,由此判断错误的是:( )
Cd(OH)2+2Ni(OH)2 ,由此判断错误的是:( )
A.放电时,Cd作负极
B.放电时,NiO(OH)作负极
C.电解质溶液为碱性溶液
D.放电时,负极反应为Cd+2OH--2e-=Cd(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体(化学组成为FeC2O4·2H2O)是一种淡黄色晶体粉末,是生产锂电池的原材料。已知FeC2O4·2H2O在300 ℃左右完全分解生成FeO、CO2、CO、H2O四种氧化物。某学习小组欲验证草酸亚铁晶体的分解产物。
I.甲组同学设计了如下实验装置:

(1)实验开始前,鼓入氮气排出空气的目的是_____________________________。
(2)检验水和二氧化碳的装置分别是_______和_______。
(3)设计实验验证装置A中黑色残留物不含有Fe3O4_______________________________________________________________(简要说明实验操作,现象和结论)。
II.乙组同学选用甲组实验中的装置A(接口用x表示)和下图所示的装置(可以重复选用)验证分解产物CO。
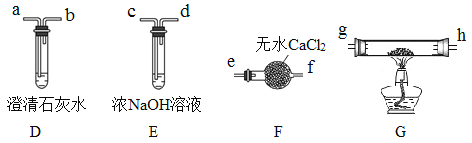
(4)乙组同学的实验装置中,依次连接的合理顺序为x→______g→h→a(用接口字母和“→”表示)。装置G反应管中盛有的物质是氧化铜。能证明草酸晶体分解产物中有CO的现象是___________。
(5)按照题目提供的装置和要求设计的实验明显存在的一个不足是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃下,现有0.1mol·L-1的H2SO4和0.1 mol·L-1一元弱酸HA两种溶液。
(1)则0.1 mol·L-1一元弱酸HA的电离平衡常数表达式Ka=______________。
(2)0.1mol·L-1的H2SO4中水电离出的C(H+)为____________。
(3)向0.1mol·L-1的硫酸中加入一定体积的pH=13的NaOH溶液,反应后溶液的pH为2,则所需NaOH溶液与硫酸的体积比为_________;
(4)向0.1 mol·L-1一元弱酸HA加入一定体积的水,在此过程中,下列数值变大的是__________。
①c(H+) ② 电离度(α) ③c(OH-) ④ Ka ⑤c(A-)/ c(HA) ⑥n(A-)
(5)实验室在配制溶液时,一些物质存在水解的情况,在配制Al2(SO4)3溶液时,Al3+也存在水解,请书写水解离子方程式__________,为了防止Al2(SO4)3发生水解,可加入少量的__________.
(6)已知25 ℃,碳酸的电离平衡常数Ka1= 4.0×10-7,Ka2= 5.6×10-11,则该温度下NaHCO3的水解平衡常数Kh=_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的短周期主族元素,A元素的一种单质是自然界最硬的物质,B为最活泼的非金属元素,C元素的原子的电子层数是最外层电子数的3倍,D元素最高化合价为+6价。
(1)D在周期表中的位置是 _____________,E的离子结构示意图_____________;
(2)C与D 形成化合物的电子式为_____________;
(3)A、D、E三种元素的最高价氧化物对应水化物的酸性由强到弱的顺序是______;
(4)由B、C、D形成的简单离子半径由大到小的顺序是________________;
(5)B形成的氢化物沸点比E形成的氢化物沸点_______(填“高”或“低”),原因是___________;
(6)DBn做制冷剂替代氟利昂,对臭氧层完全没有破坏作用,是一种很有发展潜力的制冷剂.该物质的摩尔质量为146g/mol,该物质的化学式为____。已知DBn在温度高于45°时为气态,DBn属于____晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数为x的元素E在周期表中位于A、B、C、D四种元素中间(如图所示),则A、B、C、D四种元素的原子序数之和不可能是(镧系、锕系、0族元素除外)( )
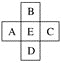
A. 4xB. 4x+14
C. 4x+10D. 4x+6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应的生成物Y的浓度在4min内由0变成了4mol/L,则以Y表示该反应在4min内的平均反应速率为 ( )
A. 16 mol/(L·min) B. 4 mol/(L·min)
C. 2 mol/(L·min) D. 1 mol/(L·min)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com