
氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:
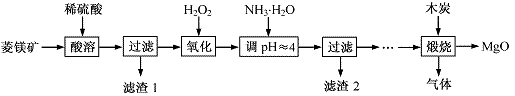
(1)MgCO3与稀硫酸反应的离子方程式为 。
(2)加入H2O2氧化时,发生反应的化学方程式为 。
(3)滤渣2的成分是 (填化学式)。
 (4)煅烧过程存在以下反应:
(4)煅烧过程存在以下反应:
2MgSO4+C 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C MgO+S↑+3CO↑
MgO+S↑+3CO↑
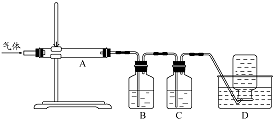
利用右图装置对煅烧产生的气体进行分步吸收或收集。
①D中收集的气体可以是 (填化学式)。
②B中盛放的溶液可以是 (填字母)。
a.NaOH 溶液 b.Na2CO3溶液 c.稀硝酸 d.KMnO4溶液
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式: 。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
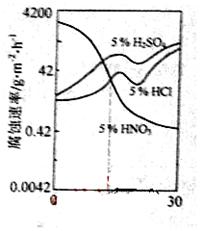
右图是一种稀硫对Fe-Gr合金随Cr含量变化的腐蚀性实验结果,下列有关说法正确的是
A.稀硫酸对Fe-Cr合金的腐蚀性比稀硫酸和稀盐酸的弱
B.稀硝酸和铁反应的化学方程式是:Fe+6HNO3(稀)—Fe(NO3)3+3NO2↑+3H2O
C.Cr含量大于13%时,因为三种酸中硫酸的氢离子浓度最大,所以对Fe-Cr合金的腐蚀性最强
D.随着Cr含量增加,稀硫酸对Fe-Cr合金的腐蚀性减弱

查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,反应后固体物质增重的是( )
A.氢气通过灼热的CuO粉末
B.二氧化碳通过Na2O2粉末
C.铝与Fe2O3发生铝热反应
D.将锌粒投入Cu(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
1.52g 铜镁合金完全溶解于50mL 密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是( )
A.该合金中铜与镁的物质的量之比是2:1
B. 该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
C.NO2和N2O4的混合气体中,NO2的体积分数是80%
D.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O。,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤:
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品。
H2SO4溶解A12O3的离子方程式是
KMnO4 - 氧化Fe2+的离子方程式补充完整:

(3)已知:生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
注:金属离子的起始浓度为0.1mol·L-1
根据表中数据解释步骤Ⅱ的目的: 。
(4)己知:一定条件下,MnO4 - 可与Mn2+反应生成MnO2。
① 向 Ⅲ 的沉淀中加入浓HCI并加热,能说明沉淀中存在MnO2的现象是 。
② Ⅳ 中加入MnSO4的目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
(1)向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。
①Mn2+基态的电子排布式可表示为 。
②NO3-的空间构型 (用文字描述)。
(2)在铜锰氧化物的催化下,CO被氧化成CO2,HCHO被氧化成CO2和H2O。
①根据等电子原理,CO分子的结构式为 。
②H2O分子中O原子轨道的杂化类型为 。
③1molCO2中含有的σ键数目为 。
(3)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
过碳酸钠(2Na2CO3·3H2O2)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂。某兴趣小组制备过碳酸钠的实验方案和装置示意图如下:
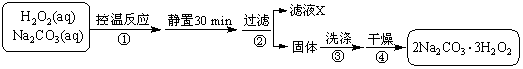 已知:主反应 2Na2CO3 (aq) + 3H2O2 (aq)
已知:主反应 2Na2CO3 (aq) + 3H2O2 (aq)  2Na2CO3·3H2O2 (s) ΔH < 0
2Na2CO3·3H2O2 (s) ΔH < 0
副反应 2H2O2 = 2H2O + O2↑
滴定反应 6KMnO4 + 5(2Na2CO3·3H2O2) +19H2SO4 =
3K2SO4 + 6MnSO4 +10Na2SO4 + 10CO2 ↑ + 15O2↑ + 34H2O
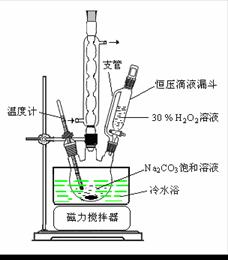 50 °C时 2Na2CO3·3H2O2 (s) 开始分解
50 °C时 2Na2CO3·3H2O2 (s) 开始分解
请回答下列问题:
(1)图中支管的作用是 。
(2)步骤①的关键是控制温度,其措施有 、
和 。
(3)在滤液X中加入适量NaCl固体或无水乙醇,
均可析出过碳酸钠,原因是 。
(4)步骤③中选用无水乙醇洗涤产品的目的
是 。
(5)下列物质中,会引起过碳酸钠分解的有 。
A.Fe2O3 B.CuO
C.Na2SiO3 D.MgSO4
(6)准确称取0.2000 g 过碳酸钠于250 mL 锥形瓶中,加50 mL 蒸馏水溶解,再加50 mL 2.0 mol·L-1 H2SO4,用2.000×10-2 mol·L-1 KMnO4 标准溶液滴定至终点时消耗30.00 mL,则产品中H2O2的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学在人类生活中扮演着重要角色,以下说法或应用正确的是 ( )
A.皂化反应指酯类物质发生碱性水解
B.光导纤维和合成纤维都属于有机高分子材料
C.苯、汽油、无水乙醇都是纯净物
D.煤经气化和液化两个化学变化过程,可变为清洁能源
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com