
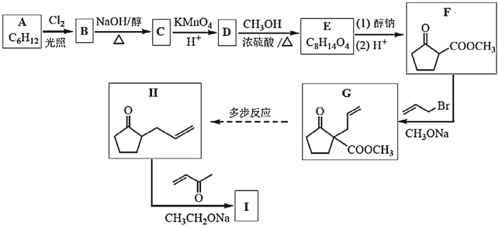
【题目】化合物I是合成六元环甾类化合物的一种中间体。合成I的路线如图:
已知:①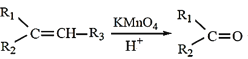 +R3COOH(—R1、—R2、—R3均为烃基)
+R3COOH(—R1、—R2、—R3均为烃基)
②![]()
③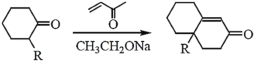
回答下列问题:
(1)苯与H2在一定条件下加成可得A,A的结构简式是___;
(2)B为一氯代物,B→C的化学方程式是___;
(3)D中的官能团名称是___;
(4)D→E的化学方程式是___;
(5)下列说法正确的是__;
a.物质F的核磁共振氢谱有2组吸收峰;
b.F→G的反应类型为加成
c.1mol物质G与氢气加成最多消耗氢气的物质的量为2mol;
d.物质H存在顺反异构体;
(6)物质I的结构简式是___;
(7)请写出以B为原料(其他试剂任选)合成![]() 的路线______。
的路线______。
【答案】![]()
![]() +NaOH
+NaOH![]() +NaCl+H2O 羧基
+NaCl+H2O 羧基 ![]() +2CH3OH
+2CH3OH![]()
![]() +2H2O c
+2H2O c ![]()
![]()
【解析】
A与氯气光照发生取代反应生成B,B发生消去反应生成C;由已知②和E分子式采用逆推法可知E为![]() ,D与甲醇发生酯化反应得到E,则D为
,D与甲醇发生酯化反应得到E,则D为![]() ,C与酸性高锰酸钾溶液反应得到D,则C为
,C与酸性高锰酸钾溶液反应得到D,则C为 ,则B为
,则B为![]() ,结合第(1)问苯与H2在一定条件下加成可得A,则推知A为环己烷,由已知③可知H经已知③的类似反应得到I,则I结构简式为
,结合第(1)问苯与H2在一定条件下加成可得A,则推知A为环己烷,由已知③可知H经已知③的类似反应得到I,则I结构简式为![]() ,以此分析。
,以此分析。
(1)苯与H2在一定条件下加成可得A,则A为环己烷,其结构简式是![]() ,故答案为:
,故答案为:![]() ;
;
(2)B为环己烷的一氯代物,其结构简式为![]() ,则B→C的过程是B的消去反应,其化学方程式是
,则B→C的过程是B的消去反应,其化学方程式是![]() +NaOH
+NaOH![]() +NaCl+H2O,故答案为:
+NaCl+H2O,故答案为:![]() +NaOH
+NaOH![]() +NaCl+H2O;
+NaCl+H2O;
(3)根据上述分析可知,D为![]() ,其官能团名称是羧基;
,其官能团名称是羧基;
(4)D→E的过程为酯化反应,其化学方程式是![]() +2CH3OH
+2CH3OH![]()
![]() +2H2O;
+2H2O;
(5)a. 根据流程图可知,物质F为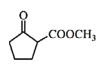 ,其分子结构中有5种等效氢,则核磁共振氢谱有5组吸收峰,故a错误;
,其分子结构中有5种等效氢,则核磁共振氢谱有5组吸收峰,故a错误;
b. F→G的过程中,会有HBr生成,其反应类型属于取代反应,而不是加成反应,故b错误;
c. G为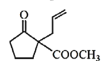 ,1mol物质G与氢气发生加成反应,最多消耗氢气的物质的量为2mol,故c正确;
,1mol物质G与氢气发生加成反应,最多消耗氢气的物质的量为2mol,故c正确;
d. 存在顺反异构体的条件:碳碳双键同一碳上不能有相同的基团,而物质H的结构简式为:![]() ,不满足条件,则H不存在顺反异构体,故d错误;
,不满足条件,则H不存在顺反异构体,故d错误;
答案选c;
(6)根据上述分析可知,物质I的结构简式是![]() ;
;
(7)B为![]() 要合成
要合成![]() ,根据卤代烃先经过消去反应得到一个碳碳双键,再与溴单质加成后得到二溴代物,最后再进行消去得到二烯烃,可设计合成路线如下:
,根据卤代烃先经过消去反应得到一个碳碳双键,再与溴单质加成后得到二溴代物,最后再进行消去得到二烯烃,可设计合成路线如下:![]() 。
。


 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
【题目】常温下,取浓度相同的NaOH和HCl溶液,以3∶2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为
A.0.01mol·L-1B.0.017mol·L-1
C.0.05mol·L-1D.0.50mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,对于某可逆反应中某一反应物从开始O点到达到平衡状态C点的过程的浓度变化情况。下列有关说法正确的是
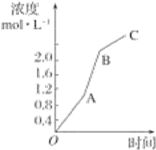
A.此可逆反应为A![]() B+C
B+C
B.反应过程中OA段的速率最快
C.反应过程中AB段的速率最快
D.反应过程中BC段的速率最快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某化学反应的平衡常数表达式为K=![]() ,在不同的温度下该反应的平衡常数如表所示:
,在不同的温度下该反应的平衡常数如表所示:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
下列有关叙述不正确的是( )
A. 该反应的化学方程式是CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
B. 上述反应的正反应是放热反应
C. 若在1L的密闭容器中通入CO2和H2各1mol,5min后温度升高到830℃,此时测得CO2为0.4mol时,该反应达到平衡状态
D. 若平衡浓度符合下列关系式:![]() ,则此时的温度为1000℃
,则此时的温度为1000℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:用Pt—Rh合金催化氧化NH3制NO,其反应的微观模型及含氮生成物产率随反应温度的变化曲线分别如所示:
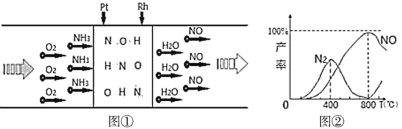
下列说法中,不正确的是( )
A.400℃时,生成的产物只有N2、NO
B.800℃时,反应的化学方程式是:4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
C.Pt—Rh合金可有效提升NH3催化氧化反应的速率
D.800℃以上,发生了反应:2NO![]() O2(g)+N2(g) ΔH>0
O2(g)+N2(g) ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4—SOCl2。电池的总反应可表示为:4Li+2SOCl2=4LiCl+S+SO2。
![]() 请回答下列问题:
请回答下列问题:
![]() (1)电池的负极材料为 ,发生的电极反应为 ;
(1)电池的负极材料为 ,发生的电极反应为 ;
![]() (2)电池正极发生的电极反应为 ;
(2)电池正极发生的电极反应为 ;
![]() (3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。 如果把少量水滴到SOCl2中,实验现象是 ,反应的化学方程式为 ;
(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。 如果把少量水滴到SOCl2中,实验现象是 ,反应的化学方程式为 ;
![]() (4)组装该电池必须在无水、无氧的条件下进行,原因是 。
(4)组装该电池必须在无水、无氧的条件下进行,原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把0.4molX气体和0.6molY气体混合于2L密闭容器中,使它们发生如下反应:4X(g)+5Y(g) ![]() nZ(g)+6W(g)。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L·min),试计算
nZ(g)+6W(g)。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L·min),试计算
(1)前2min内用W的浓度变化表示的平均反应速率为_______________。
(2)2min末时Y的浓度为_____________________________。
(3)化学反应方程式中n=_____________________________。
(4)2min末,恢复到反应前温度,体系内压强是反应前压强的__________倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年8月13日中国科学家合成了首例缺陷诱导的晶态无机硼酸盐单一组分白光材料Ba2 [Sn(OH)6][B(OH)4] 2并获得了该化合物的LED器件,该研究结果有望为白光发射的设计和应用提供一个新的有效策略。
(1)基态Sn原子价层电子的空间运动状态有___种,基态氧原子的价层电子排布式不能表示为![]() ,因为这违背了____原理(规则)。
,因为这违背了____原理(规则)。
(2)[B(OH)4] -中氧原子的杂化轨道类型为____,[B(OH)4] -的空间构型为______。 [Sn(OH)6] 2-中,Sn与O之间的化学键不可能是___。
a ![]() 键 b σ键 c 配位键 d 极性键
键 b σ键 c 配位键 d 极性键
(3)碳酸钡、碳酸镁分解得到的金属氧化物中,熔点较低的是_____(填化学式),其原因是___________。
(4)超高热导率半导体材料——砷化硼(BAs)的晶胞结构如下图所示,则1号砷原子的坐标为____。已知阿伏加德罗常数的值为NA,若晶胞中As原子到B原子最近距离为a pm,则该晶体的密度为__g·cm-3(列出含a、NA的计算式即可)。
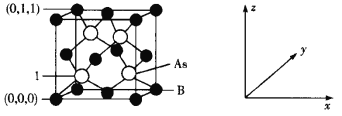
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用等浓度的NaOH溶液,分别滴定浓度均为0.1 mol/L的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断正确的是( )
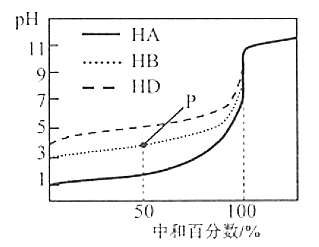
A.等浓度的三种酸中和等量的NaOH需要三种酸的体积:V(HA)>V(HB)>V(HD)
B.从滴定开始至pH=7时,三种溶液中水的电离程度逐渐增大
C.滴定至P点时,溶液中:c(HB)+c(H+)=c(B-)+c(OH-)
D.当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com