
【题目】已知:用Pt—Rh合金催化氧化NH3制NO,其反应的微观模型及含氮生成物产率随反应温度的变化曲线分别如所示:
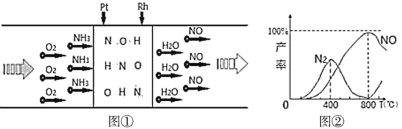
下列说法中,不正确的是( )
A.400℃时,生成的产物只有N2、NO
B.800℃时,反应的化学方程式是:4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
C.Pt—Rh合金可有效提升NH3催化氧化反应的速率
D.800℃以上,发生了反应:2NO![]() O2(g)+N2(g) ΔH>0
O2(g)+N2(g) ΔH>0
【答案】A
【解析】
A.根据图①②,结合原子守恒知,400℃时,生成的产物有N2、NO和水,故A错误;
B.800℃时,生成的含有N元素的产物主要是NO,接近100%,所以发生反应的化学方程式为4NH3+5O2![]() 4NO+6H2O,故B正确;
4NO+6H2O,故B正确;
C.400℃~800℃间,N2的产率下降、NO产率上升,且NO产率接近100%,Pt—Rh合金作催化剂可加快反应速率,所以Pt-Rh合金有效提升NH3催化氧化反应的速率,故C正确;
D.800℃以上,N2的产率上升、NO的产率下降,说明发生了反应2NO![]() O2(g)+N2(g),升高温度氮气产率增加,说明该反应的正反应是吸热反应,△H>0,故D正确;
O2(g)+N2(g),升高温度氮气产率增加,说明该反应的正反应是吸热反应,△H>0,故D正确;
故答案选A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图所示,杠杆AB两端分别挂有体积相同、质量相同的空心铜球和空心铁球,调节杠杆使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中不考虑铁丝反应及两边浮力的变化) ( )

A. 杠杆为导体和绝缘体时,均为A端高B端低
B. 杠杆为导体和绝缘体时,均为A端低B端高
C. 当杠杆为绝缘体时,A端低B端高;为导体时,A端高B端低
D. 当杠杆为绝缘体时,A端高B端低;为导体时,A端低B端高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应:2SO2(g)+O2(g)![]() 2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
A. 增大压强 B. 升高温度 C. 使用催化剂 D. 多充O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容密闭容器中,下列情况表明反应A(s)+2B(g)![]() C(g)+D(g) 已达到反应限度的是
C(g)+D(g) 已达到反应限度的是
A. 混合气体的密度保持不变B. 有1mol C生成的同时有1mol D生成
C. 混合气体的总物质的量保持不变D. 有1 mol A生成的同时有1mol C消耗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的二氧化硫和含0.7 mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应2SO2+O2![]() 2SO3。反应达到平衡后,将容器中的混合气体通过过量氢氧化钠溶液,气体体积减小了21.28 L;再将剩余气体通过一种碱性溶液吸收氧气,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)请回答下列问题:
2SO3。反应达到平衡后,将容器中的混合气体通过过量氢氧化钠溶液,气体体积减小了21.28 L;再将剩余气体通过一种碱性溶液吸收氧气,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)请回答下列问题:
(1)判断该反应达到平衡状态的标志是(填字母)__________________。
a.二氧化硫和三氧化硫浓度相等
b.三氧化硫百分含量保持不变
c.容器中气体的压强不变
d.三氧化硫的生成速率与二氧化硫的消耗速率相等
e.容器中混合气体的密度保持不变
(2)求该反应达到平衡时,消耗二氧化硫的物质的量占原二氧化硫的物质的量的百分比____。
(3)若将平衡混合气体的5%通入过量的氯化钡溶液中,生成沉淀的质量是多少?______
查看答案和解析>>
科目:高中化学 来源: 题型:
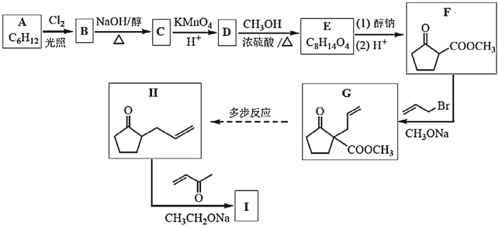
【题目】化合物I是合成六元环甾类化合物的一种中间体。合成I的路线如图:
已知:①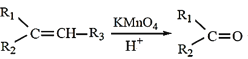 +R3COOH(—R1、—R2、—R3均为烃基)
+R3COOH(—R1、—R2、—R3均为烃基)
②![]()
③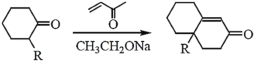
回答下列问题:
(1)苯与H2在一定条件下加成可得A,A的结构简式是___;
(2)B为一氯代物,B→C的化学方程式是___;
(3)D中的官能团名称是___;
(4)D→E的化学方程式是___;
(5)下列说法正确的是__;
a.物质F的核磁共振氢谱有2组吸收峰;
b.F→G的反应类型为加成
c.1mol物质G与氢气加成最多消耗氢气的物质的量为2mol;
d.物质H存在顺反异构体;
(6)物质I的结构简式是___;
(7)请写出以B为原料(其他试剂任选)合成![]() 的路线______。
的路线______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2SO2(g)+O2(g)![]() 2SO3(g)为放热反应,其实验数据如下:
2SO3(g)为放热反应,其实验数据如下:
压强/Mpa 转化率 温度/℃ | 0.1 | 0.5 | 1 | 5 | 10 |
450 | 97.5% | 98.9% | 99.2% | 99.6% | 99.7% |
550 | 85.6% | 92.9% | 94.2% | 97.7% | 98.3% |
(1)应选用的温度是________,其理由是______________________________。
(2)应选用的压强是________,其理由是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为10L的密闭容器中充入1mol X和1mol Y进行反应:2X(g)+Y(g)![]() Z(g),60s后反应达到平衡,生成Z的物质的量为0.3mol。下列说法正确的是
Z(g),60s后反应达到平衡,生成Z的物质的量为0.3mol。下列说法正确的是
A.X的平衡转化率为40%
B.若将容器体积变为20L,则Z的平衡浓度小于原来的![]()
C.若增大压强,则Y的平衡转化率减小
D.若升高温度,X的体积分数增大,则该反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:FeCl3+3KSCN![]() Fe(SCN)3+3KCl,离子方程式为:Fe3++3SCN-
Fe(SCN)3+3KCl,离子方程式为:Fe3++3SCN-![]() Fe(SCN)3,达到平衡后,进行下列操作,平衡怎样移动?
Fe(SCN)3,达到平衡后,进行下列操作,平衡怎样移动?
(1)加入少量FeCl3固体:平衡向____________移动;
(2)加入少量KSCN固体:平衡向____________移动;
(3)加入少量KCl固体:平衡____________移动,其理由是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com