
【题目】一定条件下,在体积为10L的密闭容器中充入1mol X和1mol Y进行反应:2X(g)+Y(g)![]() Z(g),60s后反应达到平衡,生成Z的物质的量为0.3mol。下列说法正确的是
Z(g),60s后反应达到平衡,生成Z的物质的量为0.3mol。下列说法正确的是
A.X的平衡转化率为40%
B.若将容器体积变为20L,则Z的平衡浓度小于原来的![]()
C.若增大压强,则Y的平衡转化率减小
D.若升高温度,X的体积分数增大,则该反应的ΔH>0
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某工厂废水中含游离态氯,通过下列实验测定其浓度。
①取水样10.00mL于锥形瓶中,加入10.00mLKI溶液(足量),滴入指示剂2~3滴。
②取一只碱式滴定管依次用自来水、蒸馏水洗净,然后注入0.010mol·L-1Na2S2O3溶液,调整液面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3=2NaI+Na2S4O6。
试回答下列问题:
(1)步骤①加入的指示剂是___。
(2)滴定时,眼睛应注视___,判断到达滴定终点的现象是__,若耗去Na2S2O3溶液20.00mL,则废水中Cl2的物质的量浓度为___。
(3)实验中,Cl2的所测浓度比实际浓度偏大,造成误差的原因是___。
(4)如图表示50.00mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25.00mL,滴定管中液面读数应为___mL,设此时液体体积读数为amL,滴定管中液体的体积V___(50-a)mL(填“<”、“=”或“>”)。
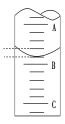
(5)滴定结束时俯视刻度线读取滴定终点时Na2S2O3溶液的体积,会导致测定结果__(填“偏大”、“偏小”或“不影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:用Pt—Rh合金催化氧化NH3制NO,其反应的微观模型及含氮生成物产率随反应温度的变化曲线分别如所示:
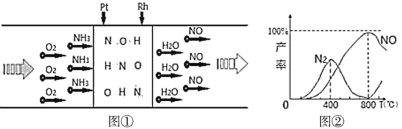
下列说法中,不正确的是( )
A.400℃时,生成的产物只有N2、NO
B.800℃时,反应的化学方程式是:4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
C.Pt—Rh合金可有效提升NH3催化氧化反应的速率
D.800℃以上,发生了反应:2NO![]() O2(g)+N2(g) ΔH>0
O2(g)+N2(g) ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把0.4molX气体和0.6molY气体混合于2L密闭容器中,使它们发生如下反应:4X(g)+5Y(g) ![]() nZ(g)+6W(g)。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L·min),试计算
nZ(g)+6W(g)。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L·min),试计算
(1)前2min内用W的浓度变化表示的平均反应速率为_______________。
(2)2min末时Y的浓度为_____________________________。
(3)化学反应方程式中n=_____________________________。
(4)2min末,恢复到反应前温度,体系内压强是反应前压强的__________倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B分别为第3、4周期同一主族的不同元素的原子,它们原子核内的质子数等于中子数。①若A为第ⅡA族元素,其质量数为x,则B的质子数为y。②若A为第ⅣA族元素,其质子数为m,则B的质量数为n,则y和n的值分别是( )
A.(![]() +18)、(2m+18)
+18)、(2m+18)
B.(![]() +8)、(2m+18)
+8)、(2m+18)
C.(![]() +8)、(2m+36)
+8)、(2m+36)
D.(![]() +18)、(2m+36)
+18)、(2m+36)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年8月13日中国科学家合成了首例缺陷诱导的晶态无机硼酸盐单一组分白光材料Ba2 [Sn(OH)6][B(OH)4] 2并获得了该化合物的LED器件,该研究结果有望为白光发射的设计和应用提供一个新的有效策略。
(1)基态Sn原子价层电子的空间运动状态有___种,基态氧原子的价层电子排布式不能表示为![]() ,因为这违背了____原理(规则)。
,因为这违背了____原理(规则)。
(2)[B(OH)4] -中氧原子的杂化轨道类型为____,[B(OH)4] -的空间构型为______。 [Sn(OH)6] 2-中,Sn与O之间的化学键不可能是___。
a ![]() 键 b σ键 c 配位键 d 极性键
键 b σ键 c 配位键 d 极性键
(3)碳酸钡、碳酸镁分解得到的金属氧化物中,熔点较低的是_____(填化学式),其原因是___________。
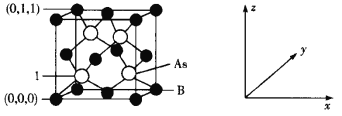
(4)超高热导率半导体材料——砷化硼(BAs)的晶胞结构如下图所示,则1号砷原子的坐标为____。已知阿伏加德罗常数的值为NA,若晶胞中As原子到B原子最近距离为a pm,则该晶体的密度为__g·cm-3(列出含a、NA的计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在Na2SO4和Al2(SO4)3的混合溶液中,测得Al3+浓度为0.1 mol·L-1,加入等体积0.3 mol·L-1的BaCl2溶液恰好使![]() 完全沉淀,则混合溶液中Na+的浓度为________。
完全沉淀,则混合溶液中Na+的浓度为________。
(2)将0.1 mol·L-1的K2SO4溶液、0.2 mol·L-1的Al2(SO4)3溶液和纯水混合,要使混合液中K+、Al3+、![]() 的浓度分别为0.1 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,则K2SO4溶液、Al2(SO4)3溶液、纯水三者的体积比________(忽略体积的变化)。
的浓度分别为0.1 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,则K2SO4溶液、Al2(SO4)3溶液、纯水三者的体积比________(忽略体积的变化)。
(3)在标准状况下,将一个充满HCl气体和氧气的集气瓶倒放于盛水的水槽中,水面上升至集气瓶容积的![]() ,把集气瓶从水中取出(假设HCl全部留在集气瓶中),若溶液密度的变化忽略不计,则HCl的物质的量浓度为________ mol·L-1。
,把集气瓶从水中取出(假设HCl全部留在集气瓶中),若溶液密度的变化忽略不计,则HCl的物质的量浓度为________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把温度为20 ℃,浓度为1.0 mol/L的H2SO4溶液和2.2 mol/L的碱溶液各50 mL混合[溶液密度均为1g/mL,比热容为4.18 kJ/(kg·℃)]轻轻搅动,测得酸碱混合液的温度变化数据如下:
反应物 | 起始温度t1 ℃ | 终止温度t2 ℃ |
H2SO4+NaOH | 20 | 33.6 |
H2SO4+NH3·H2O | 20 | 32.6 |
(1)反应NH3·H2O(aq)![]() NH4+ (aq)+OH-(aq)的焓变约____。
NH4+ (aq)+OH-(aq)的焓变约____。
(2)计算上述两组实验测出的中和热:ΔH1=___kJ/mol;ΔH2=__kJ/mol。
(3)由本题结论可预测将第1组中的1 mol/L的H2SO4溶液换成2mol/L的CH3COOH溶液进行实验,测得的中和热数值__(填“大于”“小于”或“等于”)56.848。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com