
【题目】(1)在Na2SO4和Al2(SO4)3的混合溶液中,测得Al3+浓度为0.1 mol·L-1,加入等体积0.3 mol·L-1的BaCl2溶液恰好使![]() 完全沉淀,则混合溶液中Na+的浓度为________。
完全沉淀,则混合溶液中Na+的浓度为________。
(2)将0.1 mol·L-1的K2SO4溶液、0.2 mol·L-1的Al2(SO4)3溶液和纯水混合,要使混合液中K+、Al3+、![]() 的浓度分别为0.1 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,则K2SO4溶液、Al2(SO4)3溶液、纯水三者的体积比________(忽略体积的变化)。
的浓度分别为0.1 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,则K2SO4溶液、Al2(SO4)3溶液、纯水三者的体积比________(忽略体积的变化)。
(3)在标准状况下,将一个充满HCl气体和氧气的集气瓶倒放于盛水的水槽中,水面上升至集气瓶容积的![]() ,把集气瓶从水中取出(假设HCl全部留在集气瓶中),若溶液密度的变化忽略不计,则HCl的物质的量浓度为________ mol·L-1。
,把集气瓶从水中取出(假设HCl全部留在集气瓶中),若溶液密度的变化忽略不计,则HCl的物质的量浓度为________ mol·L-1。
【答案】0.3 mol·L-1 2∶1∶1 0.045
【解析】
(1)先计算c(SO42-),再结合电荷守恒分析;
(2)设K2SO4溶液、Al2(SO4)3溶液、纯水三者的体积分别是xL、yL、zL,则0.2x=0.1×(x+y+z)、0.4y=0.1×(x+y+z)、0.1x+0.6y=0.2×(x+y+z),据此分析;
(3)HCl极易溶于水,氧气不易溶于水,所以水面上升的体积就是HCl的体积,据此分析;
(1)根据反应Ba2++SO42-=BaSO4↓,混合溶液中加入等体积0.3 mol·L-1的BaCl2溶液恰好使SO42-完全沉淀,则c(SO42-)=0.3mol/L;由电荷守恒可得:3c(Al3+)+c(Na+)=2c(![]() ),所以c(Na+)=2c(
),所以c(Na+)=2c(![]() )-3c(Al3+)=2×0.3mol/L-3×0.1mol/L=0.3mol/L。
)-3c(Al3+)=2×0.3mol/L-3×0.1mol/L=0.3mol/L。
故答案为:0.3mol·L-1;
(2)设K2SO4溶液、Al2(SO4)3溶液、纯水三者的体积分别是xL、yL、zL,则0.2x=0.1×(x+y+z)、0.4y=0.1×(x+y+z)、0.1x+0.6y=0.2×(x+y+z),解得x=2y=2z,所以K2SO4溶液、Al2(SO4)3溶液、纯水三者的体积比为2∶1∶1。
故答案为:2∶1∶1;
(3)HCl极易溶于水,氧气不易溶于水,所以水面上升的体积就是HCl的体积,设容器体积为VL,水面上升至集气瓶容积的![]() 就停止了,则氯化氢体积=
就停止了,则氯化氢体积=![]() VL,溶液体积为
VL,溶液体积为![]() VL,n(HCl)=
VL,n(HCl)= =
=![]() mol,盐酸浓度c=
mol,盐酸浓度c=![]() =
=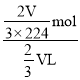 =
=![]() mol·L-1=0.045mol·L-1。
mol·L-1=0.045mol·L-1。
故答案为:0.045。


 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下的定容密闭容器中,下列情况表明反应A(s)+2B(g)![]() C(g)+D(g) 已达到反应限度的是
C(g)+D(g) 已达到反应限度的是
A. 混合气体的密度保持不变B. 有1mol C生成的同时有1mol D生成
C. 混合气体的总物质的量保持不变D. 有1 mol A生成的同时有1mol C消耗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为10L的密闭容器中充入1mol X和1mol Y进行反应:2X(g)+Y(g)![]() Z(g),60s后反应达到平衡,生成Z的物质的量为0.3mol。下列说法正确的是
Z(g),60s后反应达到平衡,生成Z的物质的量为0.3mol。下列说法正确的是
A.X的平衡转化率为40%
B.若将容器体积变为20L,则Z的平衡浓度小于原来的![]()
C.若增大压强,则Y的平衡转化率减小
D.若升高温度,X的体积分数增大,则该反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车排放的尾气是大气污染气体之一。如何减少污染气体的排放是科学家研究的热门课题。请回答下列问题:
(1)已知:CO的燃烧热为283.0kJ·mol-1,N2(g)+2O2(g)![]() 2NO2(g) ΔH= +64kJ·mol-1,则NO2(g)+2CO(g)=
2NO2(g) ΔH= +64kJ·mol-1,则NO2(g)+2CO(g)=![]() N2(g)+2CO2(g) ΔH=____kJ·mol-1,若该反应中有14g还原剂发生反应,则转移电子___mol。
N2(g)+2CO2(g) ΔH=____kJ·mol-1,若该反应中有14g还原剂发生反应,则转移电子___mol。
(2)使汽车排放的CO和NO在一定条件下发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g),可有效地减少空气污染。若在一定温度下,将6mol NO、8mol CO充入10L固定容积的容器中发生上述反应,反应过程中各物质的浓度变化如图1所示。
N2(g)+2CO2(g),可有效地减少空气污染。若在一定温度下,将6mol NO、8mol CO充入10L固定容积的容器中发生上述反应,反应过程中各物质的浓度变化如图1所示。
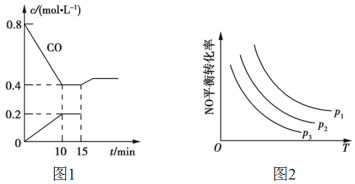
①该反应的化学平衡常数K=___。NO的平衡转化率=____。
②15min时,若改变反应条件,导致CO浓度发生如图1所示的变化,则改变的条件可能是___(填标号)。
a.缩小容器体积 b.增加CO2的量 c.体积不变通入少量氩气 d.加入催化剂
③当NO与CO的起始浓度相等时,体系中NO的平衡转化率与温度、压强的关系如图2所示,则下列说法正确的是____ (填标号)。
A.该反应ΔH<0
B.p1<p2<p3
C.升高温度正反应速率减小,逆反应速率增大
D.温度不变,增大压强,平衡常数增大
④以下说法中能判断反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g)达到平衡的是____(填标号)。
N2(g)+2CO2(g)达到平衡的是____(填标号)。
A.反应物和生成物的物质的量相等
B.单位时间内生成1mol NO同时生成1mol CO2
C.混合气体压强不再发生变化
D.NO的浓度不再变化
⑤向反应容器中再分别充入下列气体,能使NO转化率增大的是____(填标号)。
A.O2 B.N2 C.CO D.NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一体积恒定的密闭容器内发生反应A(s)+2B(g)![]() C(g)+D(g),当下列物理量不再变化时,能够表明反应已达平衡的是( )
C(g)+D(g),当下列物理量不再变化时,能够表明反应已达平衡的是( )
A.气体的压强B.气体的总物质的量
C.气体的平均密度D.C和D的物质的量比是定值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解![]() 溶液,原理如图所示。下列说法正确的是( )
溶液,原理如图所示。下列说法正确的是( )
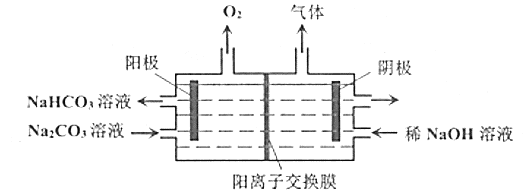
A.随着电解的进行,阴极区溶液的pH变小
B.![]() 从阴极穿过交换膜向阳极移动
从阴极穿过交换膜向阳极移动
C.若利用可逆反应原电池做此电解装置的电源,当原电池中发生的反应达平衡时,该电解装置不会停止工作
D.阳极电极反应式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:FeCl3+3KSCN![]() Fe(SCN)3+3KCl,离子方程式为:Fe3++3SCN-
Fe(SCN)3+3KCl,离子方程式为:Fe3++3SCN-![]() Fe(SCN)3,达到平衡后,进行下列操作,平衡怎样移动?
Fe(SCN)3,达到平衡后,进行下列操作,平衡怎样移动?
(1)加入少量FeCl3固体:平衡向____________移动;
(2)加入少量KSCN固体:平衡向____________移动;
(3)加入少量KCl固体:平衡____________移动,其理由是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.01mol·L-1MOH溶液的pH为10。已知:2MOH(aq)+H2SO4(aq)===M2SO4(aq)+2H2O(l) ΔH1=-24.2 kJ·mol-1;H+(aq)+OH-(aq)===H2O(l) ΔH2=-57.3 kJ·mol-1。则MOH在水溶液中电离的ΔH为( )
A. +33.1 kJ·mol-1 B. +45.2 kJ·mol-1
C. -81.5 kJ·mol-1 D. -33.1 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学仿照“喷泉”实验的原理,在实验室中做了一个“喷烟”实验,如图所示。
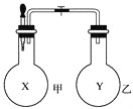
该同学在甲、乙两个烧瓶中分别充入X、Y两种无色气体,在胶头滴管中盛有含酚酞的氢氧化钠溶液,实验时将胶头滴管内的液体挤入甲烧瓶内,然后打开止水夹,便可看到甲烧瓶中的导管口喷出白色的烟,同时甲烧瓶中的溶液颜色逐渐变浅。若已知X、Y是氯化氢、氨气、氯气、氧气、甲烷、二氧化硫、一氧化氮七种气体中的两种,则下列判断中,正确的是( )
A. X是氨气,Y是氯化氢 B. X是氯气,Y是甲烷
C. X是二氧化硫,Y是氧气 D. X是一氧化氮,Y是氧气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com