
【题目】某温度下,在一体积恒定的密闭容器内发生反应A(s)+2B(g)![]() C(g)+D(g),当下列物理量不再变化时,能够表明反应已达平衡的是( )
C(g)+D(g),当下列物理量不再变化时,能够表明反应已达平衡的是( )
A.气体的压强B.气体的总物质的量
C.气体的平均密度D.C和D的物质的量比是定值
科目:高中化学 来源: 题型:
【题目】A、B、C是单质,其中A是金属,各种物质间的转化关系如图:
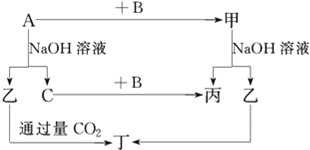
根据图示转化关系回答:
(1)写出下列物质的化学式。
A___,B___,乙___,丁___。
(2)写出下列变化的化学方程式。
①A与NaOH溶液反应的化学方程式___。
②甲与NaOH溶液反应的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下按如图安装好实验装置,在锥形瓶内盛6.5 g锌粒(颗粒大小基本相同),通过分液漏斗加入40 mL 2.5 mol·L-1的硫酸,将产生的H2收集在一个注射器中,用时10 s时恰好收集到气体的体积为50 mL(若折合成0℃、101 kPa条件下的H2体积为44.8 mL),下列说法不正确的是
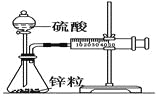
A. 用锌粒表示10 s内该反应的速率为0.013 g·s-1
B. 忽略锥形瓶溶液体积的变化,用H+来表示10 s内该反应的速率0.01 mol·(L·s)-1
C. 忽略锥形瓶内溶液体积的变化,用Zn2+来表示10 s内反应的速率0.01 mol·(L·s)-1
D. 用H2表示10 s内该反应的速率为0.004 mol·(L·s)-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所示装置回答以下问题。已知:①KMnO4常温下与浓盐酸反应可制得Cl2。②H2SiO3不溶于水。
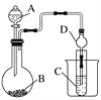
(1)利用如图装置可以验证元素非金属性的变化规律。图中A装置的名称是________________。干燥管D的作用是____________。
(2)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性强于硫:烧瓶中发生反应的离子方程式为____________________________。装置C中的实验现象为有淡黄色沉淀生成,离子方程式为_____________________。
(3)若要用此装置证明酸性:HNO3>H2CO3>H2SiO3,进而证明非金属性:N>C>Si,从以下所给物质中选出甲同学设计的实验所用到的物质:①稀HNO3 ②稀盐酸 ③碳酸钙 ④Na2SiO3溶液 ⑤SiO2。试剂A与C分别为________(填序号);试管中发生反应的离子方程式为__________________。有同学认为此实验不能说明N、C、Si的非金属性强弱,你认为原因是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应方程式对应的离子方程式正确的是
A.CuCO3+2NaOH=Cu(OH)2↓+Na2CO3 Cu2++2OH-=Cu(OH)2↓
B.Ba(OH)2+H2SO4=BaSO4↓+2H2O Ba2++SO![]() =BaSO4↓
=BaSO4↓
C.AgNO3+NaCl=AgCl↓+NaNO3 Ag++Cl-=AgCl↓
D.Cu(OH)2+H2SO4=CuSO4+2H2O OH-+H+=H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所示装置回答以下问题。已知:①KMnO4常温下与浓盐酸反应可制得Cl2。②H2SiO3不溶于水。

(1)利用如图装置可以验证元素非金属性的变化规律。图中A装置的名称是________________。干燥管D的作用是____________。
(2)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性强于硫:烧瓶中发生反应的离子方程式为____________________________。装置C中的实验现象为有淡黄色沉淀生成,离子方程式为_____________________。
(3)若要用此装置证明酸性:HNO3>H2CO3>H2SiO3,进而证明非金属性:N>C>Si,从以下所给物质中选出甲同学设计的实验所用到的物质:①稀HNO3 ②稀盐酸 ③碳酸钙 ④Na2SiO3溶液 ⑤SiO2。试剂A与C分别为________(填序号);试管中发生反应的离子方程式为__________________。有同学认为此实验不能说明N、C、Si的非金属性强弱,你认为原因是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微量元素硼和镁对植物的叶的生长和人体骨骼的健康有着十分重要的作用,其化合物也有着广泛的应用。
(1)基态B原子的价电子排布图为_____________________,其第一电离能比Be__________(填“大”或“小”)。
(2)三价B易形成配离子,如[B(OH)4]-、[BH4]-等。配离子[BH4]-的中心原子的杂化方式为________,写出与其互为等电子体的一种阳离子和一种分子的化学式:_________________。
(3)三氯化硼的沸点为12.5℃,而氯化镁的沸点高于1200℃,原因是____________________________________。
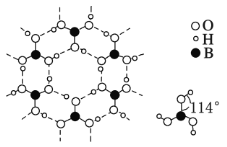
(4)硼酸晶体是片状结构,下图表示的是其中一层的结构。每一层内存在的作用力有______________;硼酸晶体在冷水中溶解度很小,但在热水中较大,原因是 _____________________________________________。
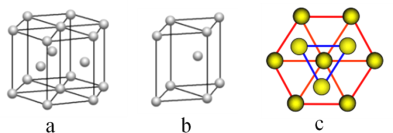
(5)镁单质晶体中原子的堆积模型如图,它的堆积模型名称为__________________;紧邻的四个镁原子的中心连线构成的正四面体几何体的体积是2a cm3,镁单质的密度为ρ g·cm-3,已知阿伏伽德罗常数为NA,则镁的摩尔质量计算式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中充有10molCO与20molH2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g)CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如图所示。下列说法正确的是( )
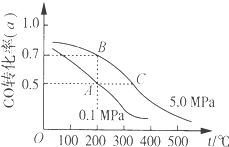
A.若A、B两点表示在某时刻达到的平衡状态,则A、B两点时容器内总气体的物质的量,n(A):n(B)=4:5
B.若A、C两点都表示已达到的平衡状态,则从反应开始至到达平衡状态所需的时间tA>tC
C.设B、C两点的平衡常数分别为KB、KC,则KB<KC
D.在不改变反应物用量的情况下,采取降温、减压或将甲醇从混合体系中分离出来均可提高CO的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置可以验证非金属性的变化规律。

(1)仪器A的名称为________,干燥管D的作用是________________。
(2)已知在常温下,高锰酸钾和浓盐酸反应能生成氯气。实验室中现有药品Na2S溶液、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫的;装置A、B、C中所装药品分别为________、________、________,装置C中的实验现象为_________________,离子方程式为______。
(3)若要证明非金属性:S>C>Si,则A中加________、B中加Na2CO3、C中加________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com