
【题目】利用如图装置可以验证非金属性的变化规律。

(1)仪器A的名称为________,干燥管D的作用是________________。
(2)已知在常温下,高锰酸钾和浓盐酸反应能生成氯气。实验室中现有药品Na2S溶液、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫的;装置A、B、C中所装药品分别为________、________、________,装置C中的实验现象为_________________,离子方程式为______。
(3)若要证明非金属性:S>C>Si,则A中加________、B中加Na2CO3、C中加________。
【答案】分液漏斗 防倒吸 浓盐酸 KMnO4 Na2S溶液 有淡黄色沉淀生成 Cl2+S2-=S↓+2Cl- 稀硫酸 Na2SiO3溶液
【解析】
(1)根据仪器的构造写出仪器A的名称;球形干燥管具有防止倒吸的作用;
(2)设计实验验证非金属性:Cl>S,利用氯气与Na2S的氧化还原反应可验证;
(3)要证明非金属性:S>C>Si,可以通过硫酸与碳酸钠反应产生二氧化碳,二氧化碳和硅酸钠反应生成难溶性的硅酸来证明。
(1)根据仪器结构可知仪器A的名称为分液漏斗,球形干燥管D能够防止倒吸,可以避免C中液体进入锥形瓶中;
(2)设计实验验证非金属性:Cl>S,利用氯气与Na2S的氧化还原反应可验证,则装置A、B、C中所装药品应分别为浓盐酸、KMnO4、Na2S溶液,装置C中的实验现象为有淡黄色沉淀生成,装置C中发生反应的离子方程式为Cl2+S2-=S↓+2Cl-;
(3)若要证明非金属性:S>C>Si,可以根据复分解反应的规律:强酸与弱酸的盐发生复分解反应制取弱酸。元素的非金属性越强,其最高价氧化物对应的水化物的酸性越强。在装置A中放入稀硫酸,在装置B中放入Na2CO3,将稀硫酸滴入碳酸钠中,发生反应:H2SO4+Na2CO3=Na2SO4+CO2↑+H2O,硫酸不具有挥发性,将反应产生的CO2气体通入到盛有硅酸钠溶液的C装置中,在C中发生反应:Na2SiO3+2CO2+2H2O=H2SiO3↓+2NaHCO3,可观察到有白色胶状沉淀产生,产生了难溶性的硅酸沉淀,证明酸性:H2SO4>H2CO3>H2SiO3,进而证明了元素的非金属性S>C>Si。


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列字母分别代表某一化学元素

(1)表格中最稳定的元素是_____(填元素符号),h在周期表的位置为_____。
(2)元素i的最高价氧化物对应水化物的化学式为_____
(3)c、d、e三种元素对应的原子半径由大到小的顺序为_____(用元素符号表示)
(4)c、h气态氢化物的稳定性强弱关系是_____(用化学式表示)
(5)写出f和i形成的化合物中所含化学键的类型_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( )
A. 达到化学平衡时4v正(O2)=5v逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C. 达到化学平衡时,若增大容器容积,则正反应速率减小,逆反应速率增大
D. 化学反应速率关系:2v正(NH3)=3v正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
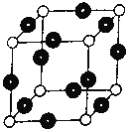
【题目】X、Y、Z、W为原子序数递增的短周期主族元素,Y的简单气态氢化物水溶液呈弱碱性, Z元素无正价,且基态原子有2个未成对电子,基态W原子价层电子排布式为nsn-1npn-1 ,X与W为同主族元素。基态R原子M能层全充满且核外有且仅有1个未成对电子。请回答下列问题:
(1)基态R原子的核外电子排布式为____________________。R单质晶体晶胞的堆积方式_______________,晶胞的空间利用率为___________________。
(2) X、Y、Z三种元素的第一电离能由小到大的顺序为__________ (填“元素符号”,下同)
(3)YF3分子中Y的杂化类型为______________。该分子的空间构型为_________________。
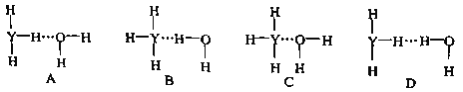
(4)Y的气态氢化物在水中可形成氢键,其氢键最可能的形式为___________________。
(5)X的某气态氧化物的相对分子质量为44,分子中的大π键可用符号Π![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则其气态氧化物中的大π键应表示为_______________,其中σ键与π数目之比为______________。
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则其气态氧化物中的大π键应表示为_______________,其中σ键与π数目之比为______________。
(6)R元素与Y元素形成某种化合物的晶胞结构如图所示(黑球代表R原子),若该晶体的密度为ρg·cm-3,则该晶胞的边长是_________cm (NA表示阿伏伽德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组从富含NaBr的工业废水中提取 Br2的过程主要包括:氧化、萃取、分液、蒸馏等步骤。已知:可能用到的数据信息和装置如下:
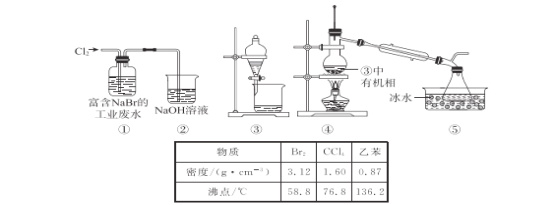
下列说法错误的是
A.实验时,①的反应的离子方程式:Cl2+2Br-=2Cl-+Br2
B.②中的玻璃直管最好换成一个倒扣的漏斗,与NaOH溶液液面相切
C.用③进行萃取时,选择CCl4比乙苯更合理
D.④中温度计水银球低于支管过多,导致Br2的产率低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源在人类生活中应用广泛。回答下列问题:
(1)氢气燃烧时放出大量的热,这是由于反应物的总能量____生成物的总能量(选填“大于”“小于”或“等于”,下同),从化学反应的本质角度来看,是由于断裂反应物中的化学键吸收的总能量_____形成产物的化学键释放的总能量。
(2)H2被认为是21世纪矿物燃料的理想能源,每克氢气和汽油燃烧放出的热量分别为55kJ和46kJ。汽油可由石油经___和____获得;请分析氢气作为能源替代汽油的优势:_____;____(写两点)。
(3)在氢氧碱性燃料电池中,负极发生反应的电极反应式:___,正极的电极反应式为____。若反应后得到5.4g液态水,此时氢氧燃料电池转移的电子数为____。
(4)如图所示的装置,在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平衡。小心地往烧杯中央滴入CuSO4溶液。

片刻后可观察到的现象是(指悬吊的金属圈)____。
A.铁圈和银圈左右摇摆不定 B.保持平衡状态不变
C.铁圈向下倾斜 D.银圈向下倾斜
(5)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
①写出FeCl3溶液腐蚀印刷电路铜板的离子方程式_____。
②若将①中的反应设计成原电池,写出负极的电极反应式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在制氯气时有如下操作,操作顺序正确的是( )
①连接好装置,检查气密性;
②缓缓加热,加快反应,使气体均匀逸出;
③在圆底烧瓶中加入二氧化锰粉末;
④从盛有浓盐酸的分液漏斗中将浓盐酸缓缓滴入烧瓶中;
⑤将多余的氯气用氢氧化钠溶液吸收;
⑥用向上排空气法收集氯气。
A.①②③④⑤⑥B.③④②①⑥⑤C.①④③②⑥⑤D.①③④②⑥⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在托盘天平的两盘上,分别放有两个质量相同的烧杯,各盛有6 mol·L-1HCl 100 mL,使天平达到平衡。分别向两烧杯中加入不超过5 g 的镁和铝,若要使其充分反应后天平仍保持平衡,则加入的镁与铝的质量之比为( )
A. 1∶1 B. 24∶27 C. 12∶9 D. 32∶33
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将足量的铜片与![]() 浓硫酸加热充分反应,收集到标准状况下的
浓硫酸加热充分反应,收集到标准状况下的![]() 气体VL,下列对此反应的有关说法中错误的是
气体VL,下列对此反应的有关说法中错误的是 ![]()
A. 该反应体现了浓硫酸的酸性和强氧化性
B. 反应结束后两种反应物均有剩余
C. 被还原的硫酸为![]()
D. 参加反应的Cu为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com